お知らせ
感染症情報
研究・検査・病原体管理
サーベイランス
刊行・マニュアル・基準
- 詳細
マイコプラズマ肺炎 2023年現在
(IASR Vol. 45 p1-2: 2024年1月号)マイコプラズマ肺炎は一般にみられる肺炎で, 流行時には市中肺炎全体の20-30%を占めることもある。病原体の肺炎マイコプラズマ(Mycoplasma pneumoniae: M. pneumoniae)は, 細菌としてはゲノムサイズが約800kbと小さく, 増殖にコレステロールなど多くの栄養素を要求するが, 人工の培地で純培養が可能である(本号3ページ)。ペプチドグリカン細胞壁を欠くため, β-ラクタム系の抗菌薬は効果がない。感染経路は主に飛沫感染と接触感染で, 家族内や学校など濃厚接触が多い場所で, しばしば集団発生が起こる。患者は小児, 青年期年齢層に多く, 潜伏期間は感染後2~3週間程度である。症状は発熱, 全身倦怠感, 頭痛, 咳などで, 解熱後も咳が長く続くことがある。M. pneumoniaeによる呼吸器感染症は肺炎に至らない気管支炎症例も多く, 肺炎の場合も比較的症状が軽いため, 英語では“walking pneumonia”という呼び名もある。これは肺炎を発症していても患者が起きて歩けるからである。一方で, 重症化して入院治療が必要な症例もある。また, M. pneumoniaeは呼吸器以外にも造血器系, 心血管系, 消化器系, 泌尿器系, 中枢神経系, 皮膚・粘膜などに炎症をはじめ, 様々な病変や合併症を起こすことがある。現時点で有効なワクチンはない。
- 詳細
高齢者肺炎球菌感染症に対する定期接種率と累積接種率の推計値について
(IASR Vol. 45 p12-14: 2024年1月号)2014年10月に高齢者の肺炎球菌感染症は個人予防目的に比重を置くB類疾病に位置付けられ, 肺炎球菌ワクチン(23価莢膜ポリサッカライドワクチン: PPSV23)が定期接種に導入された。65歳の者および60歳以上65歳未満で日常生活が極度に制限される程度の基礎疾患を有する者を対象として, 1回接種することとなった。
- 詳細
| 【速報一覧へ戻る】 | |
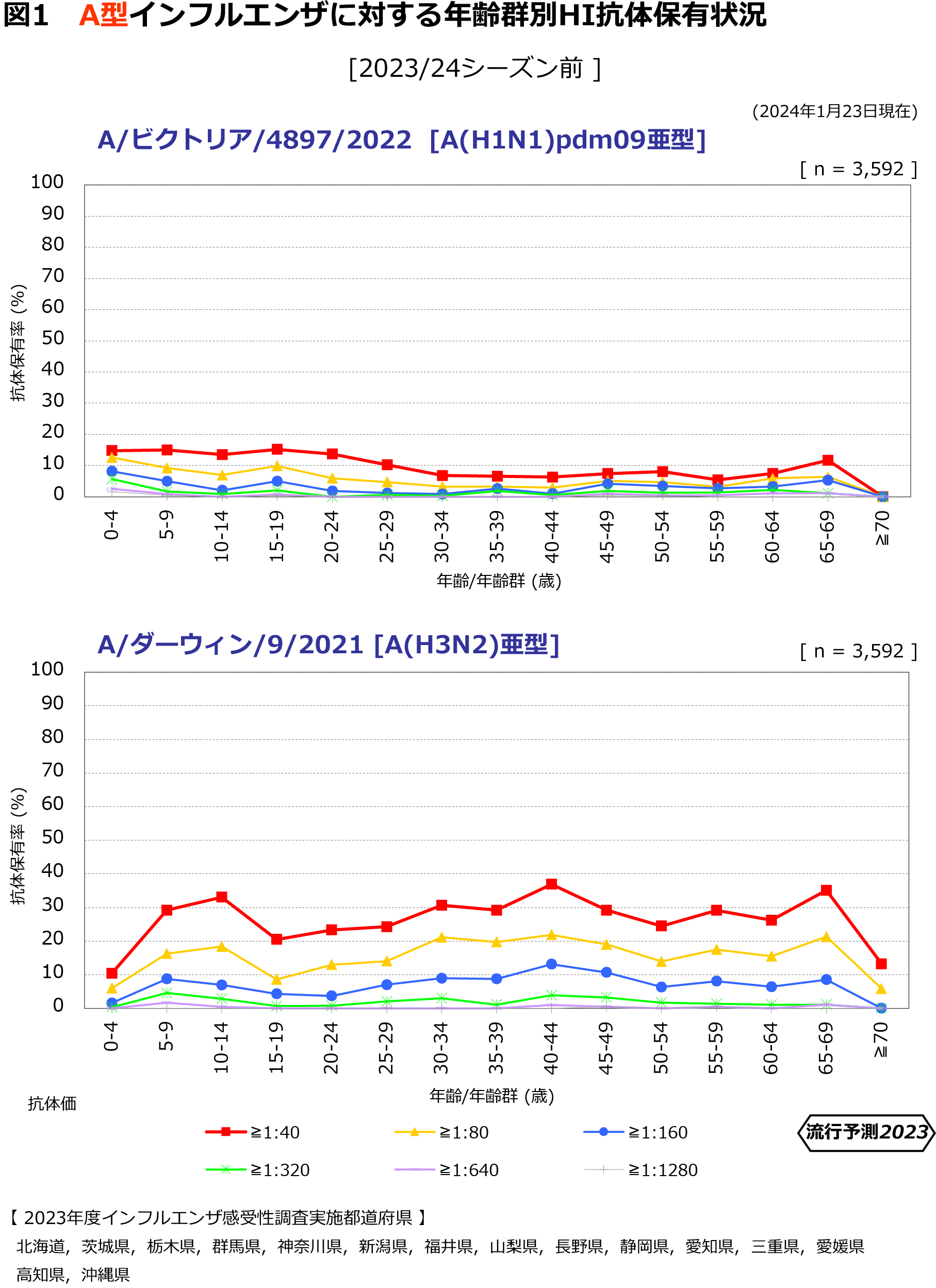
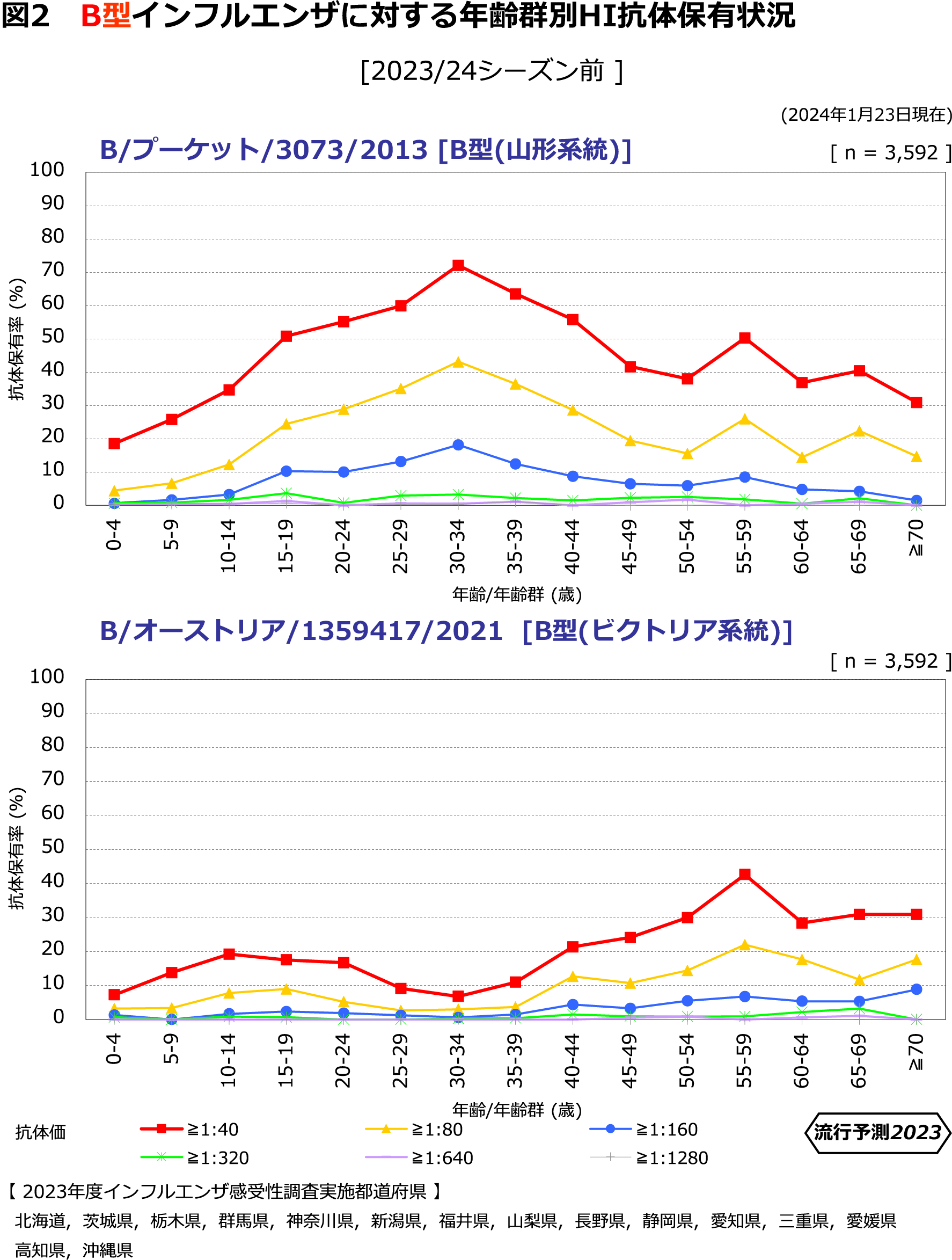
| インフルエンザ抗体保有状況 -2023年度速報第2報- (2024年1月23日現在) | |
|
はじめに |
|
|
1. 調査対象および方法 |
|
|
2. 調査結果 |
|
|
【年齢群別抗体保有状況】 |
|
|
コメント |
|
国立感染症研究所 感染症疫学センター/インフルエンザ・呼吸器系ウイルス研究センター |
|
- 詳細
 注目すべき感染症 ※PDF版よりピックアップして掲載しています。
注目すべき感染症 ※PDF版よりピックアップして掲載しています。
◆インフルエンザ
インフルエンザは、インフルエンザウイルスを原因病原体とする急性の呼吸器感染症で、世界インフルエンザは、インフルエンザウイルスを原因病原体とする急性の呼吸器感染症で、世界中で流行がみられる。主な感染経路は、咳、くしゃみ等により発生する飛沫による感染(飛沫感染)であるが、物の表面等に付着した飛沫に触れた手指を介した接触感染もある。症状としては、発熱、頭痛、全身倦怠感、筋肉痛・関節痛などが出現し、鼻汁・咳などの呼吸器症状がこれに続く。通常の感冒と比べて全身症状が強いことが特徴であるが、通常は1週間前後の経過で軽快する。症状のみで新型コロナウイルス感染症(COVID-19)との鑑別は困難である。
インフルエンザの発生状況は、感染症法に基づき、全国約5,000カ所のインフルエンザ定点医療機関(小児科定点約3,000、内科定点約2,000)から毎週、届出される患者数等から把握されている。2022/23シーズンは報告が非常に低調で、全国的な流行開始の指標である定点当たり報告数1.00を上回った週が一度もなかった2020/21、2021/22シーズンとは異なり、インフルエンザの報告数は増加し、2022年第51週には定点当たり報告数1.24と流行開始の指標を上回った(シーズン:第36週~翌年第35週)。2022/23シーズンの立ち上がりは、COVID-19パンデミックが始まる前の2017/18、2018/19シーズンと比較して遅かったが、その後流行が拡大し、2023年第6週に全国の定点当たり報告数が12.91となりピークを迎えた。以降、報告数は減少したものの、1.00を下回ることなく、2023/24シーズンに入った。2023/24シーズンは、2023年第45週、第48週を除き定点当たり報告数の増加が継続し、第49週には33.72(報告数166,690)となった。その後、第50週の報告数は29.94と減少に転じ、2024年第1週においては年始が含まれるため動向の解釈に注意を要するが、12.66(報告数61,918)と減少傾向が続いた(インフルエンザの年別・週別発生状況:https://www.niid.go.jp/niid/ja/10/2096-weeklygraph/1644-01flu.html)。一方、週ごとの定点当たり報告数は、過去5年間の同時期(前週、当該週、後週の合計15週の平均)と比較してかなり多い状況であった(本号5ページ「定点把握疾患の報告の過去5年間の同時期との比較(2024年第1週)」参照)。なお、2024年第1週(2024年1月1〜7日)の都道府県別の定点当たり報告数は、宮崎県(26.05)、茨城県(22.34)、岐阜県(20.82)、大分県(19.21)、沖縄県(18.85)、秋田県(17.37)、福岡県(17.29)、愛知県(16.94)、長崎県(16.94)、福島県(16.46)、高知県(16.39)、熊本県(15.94)、滋賀県(14.93)、鹿児島県(14.89)、千葉県(14.58)、香川県(13.85)、埼玉県(13.82)、三重県(13.82)、鳥取県(13.79)、徳島県(13.59)、長野県(13.44)、石川県(12.84)、青森県(12.66)、岩手県(12.56)、佐賀県(12.49)、大阪府(11.67)、島根県(11.66)、静岡県(11.59)、宮城県(11.26)、山口県(11.22)、京都府(11.16)、福井県(11.15)、新潟県(11.02)、岡山県(10.98)、広島県(10.85)、山形県(10.74)、和歌山県(10.63)、群馬県(10.44)、富山県(10.38)、北海道(10.15)、愛媛県(9.97)、兵庫県(9.91)、山梨県(8.44)、奈良県(8.25)、栃木県(7.97)、東京都(7.83)、神奈川県(7.77)の順となっている。45都道府県で前週の報告数より減少がみられた。また、直近3週間(2023年第50週〜2024年第1週)の累積報告数の男女比は、15歳未満の年齢群では1.1:1、15〜19歳の年齢群では1.2:1、20〜29歳の年齢群では1.1:1と男性に多く、30〜49歳の年齢群では1:1.2とやや女性に多かった。小児では男性が多く、30~40代では女性が多い傾向は、例年と同様である。
定点医療機関からの報告を基に、2024年第1週に定点以外を含む全国の医療機関を受診した患者数を推計すると、約48.7万人(95%信頼区間:44.6~52.8万人)となり、前週の推計値(約76.9万人)よりも減少した。年齢別では、0~4歳が約4万人、5~9歳が約3.9万人、10~14歳が約3.7万人、15~19歳が約4.1万人、20代が約9.3万人、30代が約5.9万人、40代が約5.7万人、50代が約5.4万人、60代が約3.3万人、70歳以上が約3.4万人となっている。2023年第36週~2024年 第1週の推計受診者数の累積は約1107.4万人となった(2024年1月10日現在)。
病原体サーベイランスにおける、インフルエンザウイルス分離・検出速報によると(https://www.niid.go.jp/niid/ja/iasr-inf.html)、2023/24シーズンのインフルエンザウイルス分離・検出報告数は、2024年1月10日現在、AH3亜型が1,526株、AH1pdm09が783株、B型が44株(ビクトリア系統43株、系統不明1株)検出されている。また、直近5週間の2023年第49週~2024年第1週では、AH3亜型が103株(57%)、AH1pdm09が64株(35%)、B型が14株(8%)であった。
インフルエンザ入院サーベイランス(全国約500カ所の基幹定点医療機関が週毎に報告するインフルエンザによる入院患者数、より重症な症例数の推移を反映する)においては、2023年第36週以降、継続して増加傾向であったが、第49週1,292例、第50週1,331例、第51週971例、第52週1,161例、2024年第1週1,162例と、直近の数週間は減少傾向であった。ただし、直近の週は届出の遅れ等で少なく集計される場合があることに注意が必要である。2024年第1週の年齢別の報告数は、1歳未満(55例)、1~4歳(135例)、5~9歳(72例)、10代(32例)、20代(21例)、30代(24例)、40代(34例)、50代(58例)、60代(116例)、70代(225例)、80歳以上(390例)であった。今シーズンの基幹定点におけるインフルエンザによる入院患者の累積報告数は11,993例となり、10歳未満が4,212例(35.1%)、70歳以上が4,543例(37.9%)であった(2024年1月10日現在)(インフルエンザの発生状況について:https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/kenkou_iryou/kenkou/kekkaku-kansenshou01/houdou.html)。
2023/24シーズンの急性脳炎(5類感染症全数把握対象疾患)におけるインフルエンザ脳症は、2023年第36週から第52週にかけて114例(疑い症例を含む暫定値)の報告があり、同時期に報告のなかった2021/22、2022/23シーズンと比較して大きく増加した。検出されたインフルエンザウイルスはA型97例(85%)、インフルエンザ疑い例2例を含む型不明例17例(15%)であった。インフルエンザ脳症の直近5週の報告数は第49週に10例(A型9例、型不明1例)、第50週に13例(A型11例、型不明2例)、第51週に12例(A型11例、型不明1例)、第52週に5例(A型5例)、2024年第1週に報告はなかった。ただし最直近の週は届出の遅れ等で少なく集計される場合があること、当該週は年始を含んでいることに注意が必要である(2024年1月10日現在)。
感染症法に基づくサーベイランス以外の情報においてインフルエンザの流行状況を示唆する情報として、全国の保育所・幼稚園、小学校、中学校、高等学校におけるインフルエンザ様症状の患者による休校数、学年閉鎖数、学級閉鎖数を集計する学校サーベイランス〔インフルエンザ様疾患発生報告(学校欠席者数):https://www.niid.go.jp/niid/ja/flu-flulike.html〕と国立病院機構140病院において医師がインフルエンザを疑い、インフルエンザ迅速抗原検査を実施した検査件数と検査陽性数が報告されることにより、検査陽性率が把握できる「国立病院機構におけるインフルエンザ全国感染動向」(https://nho.hosp.go.jp/cnt1-1_0000202304.html)がある。
学校サーベイランスでは、2023年第36〜52週までのインフルエンザ様症状の患者による休校数、学年閉鎖数、学級閉鎖数の累積は、休校1,305件、学年閉鎖12,932件、学級閉鎖44,479件となり(2024年1月10日現在)、2022/23シーズンの同時期の累積の休校2件、学年閉鎖33件、学級閉鎖150件を大きく上回り、インフルエンザ様症状を示す患者の増加を示した。「国立病院機構におけるインフルエンザ全国感染動向」では、10月上旬~中旬以降、検査数・陽性数・陽性率は継続して増加傾向であった。直近の2023年12月16~31日に関して、前年の同時期の結果と比較すると、検査件数はほぼ倍増したが(6,439件→13,755件)、検査陽性件数は10倍以上増加し(151件→2,013件)、結果、検査陽性率が2.3%から14.6%に増加した。これらはインフルエンザ様疾患においてインフルエンザ症例が増加したことを示している。
例年インフルエンザは、11月末から12月にかけて流行開始の指標である全国の定点当たり報告数が1.00以上となる(https://www.niid.go.jp/niid/ja/diseases/a/flu.html)。2023/24シーズンは、2023年9月(第36週)時点で定点当たり報告数が4.48であり、シーズン開始時において前シーズンの流行が継続していた。以降、週毎報告数は、例年と比較してかなり高い値で推移している。また、COVID-19の定点当たり報告数についても、2023年第47週以降増加が継続している(新型コロナウイルス感染症サーベイランス週報:https://www.niid.go.jp/niid/ja/2019-ncov/2484-idsc/12015-covid19-surveillance-report.html)。二つの感染症への個人の予防策として、マスクの適切な着用を含む咳エチケット、手指衛生の徹底、適切な換気の実施等が推奨される。医療・福祉施設へのウイルスの持ち込みを防ぐことや、ワクチン(インフルエンザワクチン、新型コロナワクチン)の接種を検討することも重要である。なお、2023/24シーズンは、例年通りA型2亜型とB型2系統による4価のインフルエンザワクチン(https://www.niid.go.jp/niid/ja/flu-m/2066-idsc/related/584-atpcs002.html)が製造されており、65歳以上の高齢者、又は60〜64歳で心臓、腎臓若しくは呼吸器の機能に障害があり、身の回りの生活が極度に制限される者、あるいはヒト免疫不全ウイルス(HIV)により免疫機能に障害があり、日常生活がほとんど不可能な者は、予防接種法上の定期接種の対象となっている(https://www.mhlw.go.jp/stf/index2023.html)。2023/24シーズンを通したインフルエンザワクチンの供給量は、3,121万本(成人に対して約6,242万回分)が見込まれている(https://www.mhlw.go.jp/content/001148196.pdf)。
諸外国においては、COVID-19パンデミックの発生以降、インフルエンザの流行が過去と異なるタイミングで開始した報告などがみられており、今後の動向についても注視が必要な状況である(世界保健機関Influenza Update:https://www.who.int/teams/global-influenza-programme/surveillance-and-monitoring/influenza-updates)。こうした中で、本稿で示したように複数の指標を用いて、インフルエンザの動向を包括的に監視していくことが重要である。
今後のインフルエンザの感染症発生動向調査には注意をしていただくとともに、これらの詳細な情報と最新の状況については、以下を参照いただきたい。
●感染症発生動向調査週報(IDWR)
https://www.niid.go.jp/niid/ja/idwr.html
●インフルエンザ流行レベルマップ
https://www.niid.go.jp/niid/ja/flu-map.html
●インフルエンザウイルス分離・検出速報
https://www.niid.go.jp/niid/ja/iasr-inf.html
●今冬のインフルエンザについて(2022/23シーズン)
https://www.niid.go.jp/niid/images/idsc/disease/influ/fludoko2023.pdf
●インフルエンザ2022/23シーズン
https://www.niid.go.jp/niid/ja/iasr-vol44/12366-idx525.html
●令和5年度 今シーズンのインフルエンザ総合対策について
https://www.mhlw.go.jp/stf/index2023.html
●令和5年度インフルエンザQ&A
https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/kenkou_iryou/kenkou/kekkaku-kansenshou/infulenza/QA2023.html
●インフルエンザ啓発ツール
https://www.mhlw.go.jp/bunya/kenkou/kekkaku-kansenshou01/keihatu.html
国立感染症研究所 感染症疫学センター
- 詳細
A群溶血性レンサ球菌による劇症型溶血性レンサ球菌感染症の50歳未満を中心とした報告数の増加について(2023年12月17日現在)
(速報掲載日 2024/1/15) (IASR Vol. 45 p29-31: 2024年2月号)背景・目的
劇症型溶血性レンサ球菌感染症(streptococcal toxic shock syndrome: STSS)は、急激かつ劇的な病状の進行を特徴とする致命率の高い感染症である。STSSは、感染症法に基づく感染症発生動向調査において、5類全数把握疾患と定められている。届出に必要な要件は、ショック症状に加えて肝不全、腎不全、急性呼吸窮迫症候群、播種性血管内凝固症候群、軟部組織炎、全身性紅斑性発疹、中枢神経症状のうち2つ以上をともない、かつ通常無菌的な部位(血液など)等からβ溶血を示すレンサ球菌が検出されることであり、要件を満たすと診断された場合、届出対象となる。STSSの病原菌は、A群溶血性レンサ球菌(group A Streptococcus: GAS, Streptococcus pyogenes)の他、B群、C群、G群の溶血性レンサ球菌などがある。本稿では、感染症発生動向調査上、STSSとして届出された症例のうちGASによる症例(以下、GASによるSTSS症例)について述べる。
続きを読む: A群溶血性レンサ球菌による劇症型溶血性レンサ球菌感染症の50歳未満を中心とした報告数の増加について(2023年12月17日現在)