(4)どのようにして両方の12番相同染色体に欠失ができたのだろうか
上述したように12番染色体に起こった9 Mbpの欠失は、多様なウイルスに対して感受性の高い不死化細胞というVero細胞の特色に合致したゲノム上の特徴となっていると思われます。不思議なことにこの欠失領域は二本ある相同染色体の間でDNA塩基レベルで見ても完全に同一なのです。このようなことが起こった経緯に対しても全ゲノム解析結果は重要な示唆を提供しました。
12番染色体の一塩基多様性を調べると、この9 Mbpの欠失領域の両側約60 Mbpに渡って一塩基多様性が他の領域に比べて極めて低いことがわかりました(図4)。雄雌別の個体の配偶子の合体で二倍体となる脊椎動物細胞では、相同染色体どうしといえども一塩基レベルでは多くの違いがあるのが普通です。そのような一塩基多様性が消失していることをヘテロ接合性の消失(loss of heterozygosity; LOH)と呼びます。特定の領域にLOHが存在することは、その領域に限定された遺伝子転換gene conversionが最近起こり、もともとは片方の染色体だけにあった配列にもう一方も置き換えられたことを強く示唆しています。
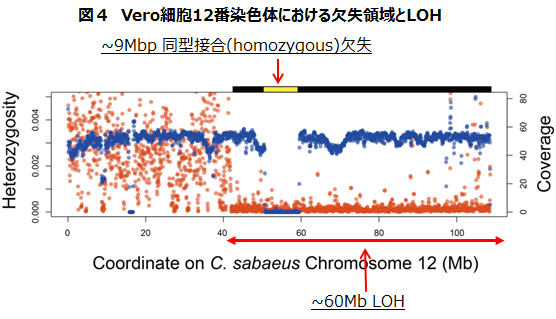
ゆえに、12番相同染色体の片方で9 Mbpの欠失 --> 当該欠失を含む両側で60 Mbpに渡る大規模な遺伝子転換 --> 12番相同染色体の両方で9 Mbpの欠失、というようなゲノム構造上の事象がVero細胞の誕生の過程では起こったと推定できます。
(5)Vero細胞系列の確認試験として欠失領域情報を利用する
自身の実験などで使用している細胞が本当にその細胞であることを定期的に確認している研究者がどれくらいいるでしょうか?
培養細胞の取違いということは、思ったよりも頻繁に起こっている可能性があります(余談7)。同じ研究室内で複数の種類の細胞を扱う場合には、特に使用する培地ボトルや安全キャビネットの使用時間を別々にするといった注意が必要です。そのような実験手順上の注意をしたうえで、ときどきは細胞の同定試験をして確認できれば理想的といえましょう。
とはいえ、従来の細胞の同定試験は、手間や費用さらには高い技術が必要な場合もあって、生物医薬品製造工場とか細胞バンクといった細胞の品質管理を業務の一環として行っているところを除けば、あまり普及していないのが実状と思われます。しかし、自分の使用している細胞が実は別の細胞であったときの悪夢を考えれば、定期的なチェックをしておくことは重要なリスク管理の一つです。
Nature及びその姉妹誌は投稿原稿中で使用した細胞の確認情報を明記するように2015年から義務付けています。同様のルールは他の雑誌にも広がっていくことでしょう。このような時代の動きを考えるとき、各実験室で簡便に実施できる細胞同定試験の開発は、地味ではありましょうが、多くの生命科学分野を下支えする重要な課題と私は考えています。
両方の相同染色体から欠失してゲノムから失われた遺伝子は、相同染色体間の組み換えではもはや再生できませんので、Vero細胞のこれら遺伝子の欠失は「安定」に受け継がれることになります。したがって、ある細胞系列に特徴的なゲノム領域欠失は、その細胞系列の同定試験に利用できると期待できます。
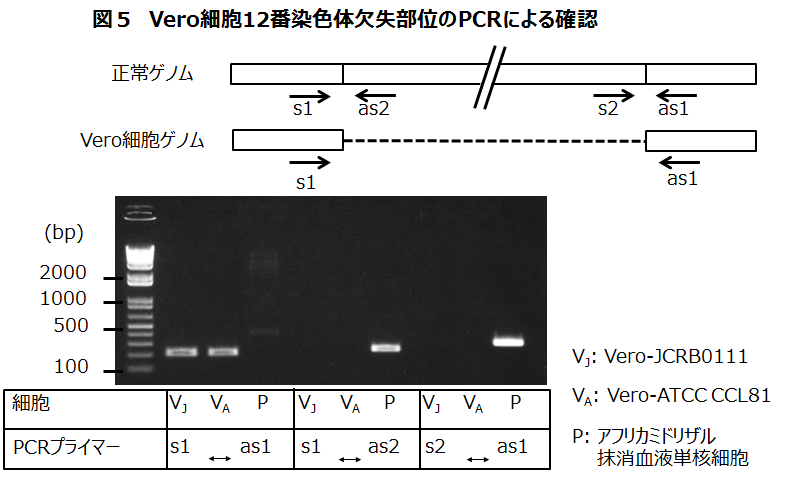
全ゲノム配列決定の途上で、私たちは上述した12番染色体上の9 Mbp欠失以外にも大小数多くの欠失の存在を見つけており、そのいくつかはゲノミックPCRとその増幅DNA断片(200-300塩基程度)のシーケンシングによって確認しています(図5)。
この方法は、とても簡便かつ低コストのVero細胞確認試験になると思います。自分の使用している細胞が本当にVero細胞であることを確認したい人は12番染色体上の9 Mbp欠失だけでもPCRで確認するとよいでしょう。PCR条件はプライマー配列も含めて当該論文のsupplementaryに詳述しています。
(6)内在性レトロウイルス配列の多様性
RNA配列から相補的なDNA配列を合成する逆転写酵素をゲノム上にコードするRNAウイルスをレトロウイルスretrovirusと呼びます。細胞に感染したレトロウイルスは、自身のRNAゲノムの情報をコピーした二重鎖DNAを作り出し、それを宿主細胞の核ゲノムに挿入させてあたかも宿主細胞ゲノムの一部としてウイルス遺伝子情報を維持します。
エイズを発症させるヒト免疫不全ウイルス(human immunodeficiency virus; HIV)もレトロウイルスの一つですが、全てのレトロウイルスが病原性というわけではなく、レトロウイルスもしくはそれに似た配列は正常な動物細胞でもゲノム上に多数存在していて、このような配列は真核生物ゲノムがいろいろと変化していく過程(生物種として生き残る変化であれば「進化」と呼ばれる)に不可欠な働きをしたと考えられています。
Vero細胞はtype D simian retrovirus (SRV)と呼ばれるサルのレトロウイルスの配列をゲノムにもっていて、RNAの形へと転写もされていることが知られており、そのRNA配列に関しても過去に報告があります[23, 24]。私たちがゲノム配列を決定したJCRB0111株のゲノムにもSRV配列は見出されました。
黒田グループがさらに詳細に解析してみると、JCRB0111株のゲノム上のSRV配列には別のVero細胞株由来SRV配列では報告されていない変異があり、さらに、後者のSRV配列で存在する変異がJCRB0111株由来SRV配列には見つかりません。このVero細胞亜株間のSRV配列多様性は、亜株間を区別するゲノム情報になるかもしれず、今後も注目してゆきたいと考えています。
11.今後の展望
私が語るVero細胞の物語はひとまずここでおしまいです。しかし、長々と紹介したVero細胞のゲノム構造の研究成果は、今後いろいろなことに役立つ基盤を提供しており、私たち自身もこの基盤に立脚した研究展開をしてゆきたいと考えています。その方向性を最後に少し述べます。
一つの柱は、ゲノム情報に基づいた細胞品質管理手法の改良・開発です。Vero細胞の特性に密接に関わる特徴的なゲノム欠失を活用した細胞同定試験という方向性については、上で述べた通り、その概念証明(proof of concept)を済ませました。さらに新しい展開として、Vero細胞亜株間でのSRVの配列多様性をより広く調べ、どのようにしてそのような多様性が起こるのかというサイエンスとともに、得られた知見が細胞亜株を区別する品質管理手法へとつながればと考えています。
もう一つの大きな柱は、Vero細胞の改良です。Vero細胞はウイルスワクチン生産用の細胞基材として広く使われており[25, 26]、一方で、新興再興感染症として世界の脅威になった・なっている病原体についても、最初に分離するために用いる宿主細胞としてVero細胞はほぼ「第一選択細胞」として利用されています[9-11]。これらの用途に向けてさらに使いやすい改良型Vero細胞をゲノム編集技術を駆使して作製したいと考えています。
このような方向性の研究に興味のある方は是非ご一緒に。