1.はじめに
生物は,どのようにしてそのダイナミックな秩序を生み出して維持しているのでしょうか?そのためには少なくとも、あるべき物を,あるべき時に、あるべき場所へ配置するシステムが備わっていなければならないはずです。このシステムの成り立ちを分子レベルで明らかにすることこそが現代生物学の主流であると私は思っています。
物質代謝という古典的とみなされがちな研究分野でさえ、上に提起した問題はじゅうぶん解き明かされているわけではありません。とくに「場所」の問題は,細胞内のようなミクロな場に対しての良い解析手段が限られていることもあり、多くのことが未解明です。
ヒトからカビにいたるまで、よく目にする生物のほとんどは、染色体chromosomeをしまっている核nucleusとよばれる構造をもつので、真核生物eukaryotesに分類されます。真核生物の細胞には、核以外にも膜で囲まれたさまざまな細胞内小器官(オルガネラorganelle)が存在します。真核細胞においては、小胞体endoplasmic reticulumが脂質合成の最重要拠点であり、小胞体で合成されたさまざまな脂質は、それぞれにことなるオルガネラへと移動しています。膜タンパク質が小胞体から別のオルガネラへ移動するときには、もっぱら輸送小胞transport vesiclesとよばれる小さな膜の包みに乗って動くことがよく知られている一方で、小胞体で合成された脂質は、輸送小胞を利用せずに目的地へと移動しているらしいことが指摘されていました。しかし、その実態はなかなかわからずにいました。
私たちは、この生物の基本的な問題に、独自のアプローチをもちいて長いあいだ取り組んできました。その成果として、脂質セラミドceramideが小胞体からゴルジ体Golgi apparatusへと選ばれて輸送されるときに重要な働きをする遺伝子とそのタンパク質産物を2003年に発見しました。これらの発見などが突破口となって、オルガネラ間の脂質選別輸送interorganelle lipid traffickingの研究もようやく分子メカニズムに迫れる時代に突入してきています。以下、私たちが行っている脂質選別輸送に関する研究のあゆみを詳しくご紹介します。
2.細胞内の脂質選別輸送
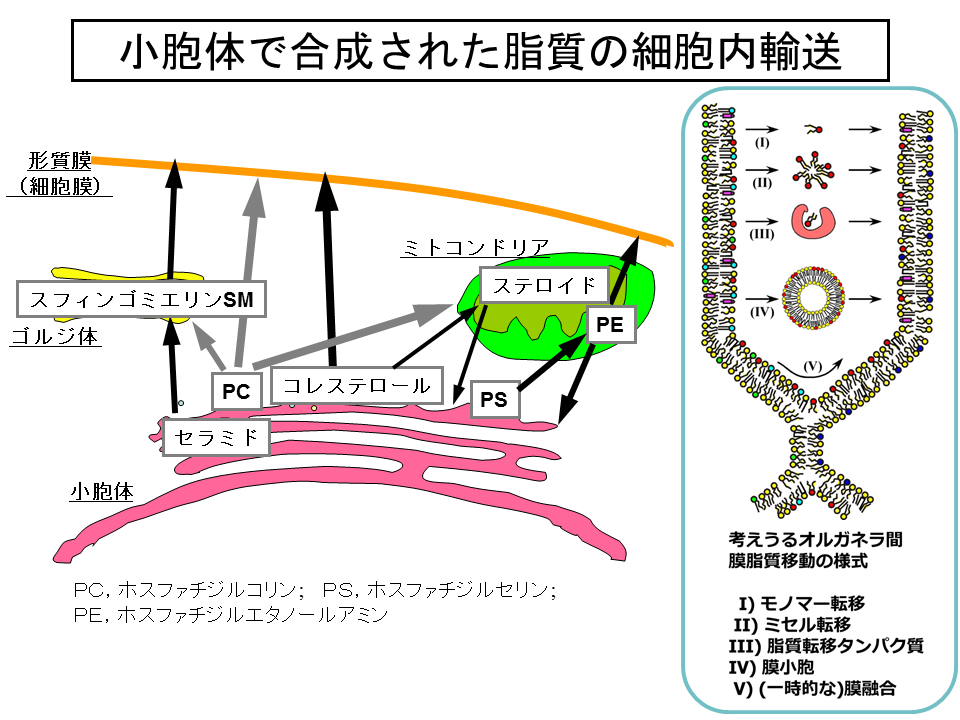
真核細胞における膜脂質の生合成では、ことなるオルガネラの膜でおきる複数の代謝ステップを経ることがしばしば必要となります。たとえば、小胞体で合成されるリン脂質phospholipidのひとつであるホスファチジルセリンphosphatidylserineは、ミトコンドリアmitochondriaへと移動し、そこで脱炭酸反応を受けて、もうひとつの主要な膜リン脂質であるホスファチジルエタノールアミンphosphatidylethanolamineへ変換されます(図1)[1]。
図1
また、生合成的には最終産物となっても、生産の場からほかの膜系へと移動することが、それぞれの脂質の働きに必要な場合もあります。たとえば、コレステロールcholesterolは、小胞体で合成されたのちに、おもに形質膜plasma membrane(細胞膜cell membraneともいう)へと速やかに移動して形質膜の機能をコントロールする役割をはたしています(図1)[1, 2]。
核という細胞内構造をもたない原核生物prokaryotesすなわち細菌は、細胞の表面にしか膜系がありません。細菌の表層envelopeは、通常、内膜と外膜とよばれる二つのリン脂質膜系から成り立っています。細菌では、脂質の生合成はもっぱら内膜でおきていますので、外膜形成のためには、内膜で合成された脂質が外膜に移らねばなりません。グラム陰性細菌Gram-negative bacteriaの表層構成因子であるリポ多糖lipopolysaccharidesも内膜で生合成されたのちに、最終目的地である外膜へと移動しています[3, 4]。
では、どのようにして、特定のオルガネラ膜にあるさまざまな脂質のなかから特定の脂質を選びだしてほかのオルガネラ膜へと運んでいるのでしょうか?その様式として、図1の挿入図にあるような五つのメカニズムが推定されていましたが、実際にどのような様式で運ばれているのかは、どの種類の脂質をとってみても、また、どの種類の細胞をとってみてもほとんどわからないままでした。
当研究部では、哺乳動物細胞におけるスフィンゴ脂質sphingolipidの代謝と機能の研究を突然変異細胞株mutant cell linesを利用して進めています。そのなかで、セラミドが小胞体膜からゴルジ体膜へと選択的に運ばれる際に中心的な役割をするタンパク質をみいだしました。小胞体膜からゴルジ体へのセラミド輸送は、細胞内の脂質選別輸送のモデル系として、その研究成果が少しずつほかの研究分野へも波及するようになってきています。
3.スフィンゴ脂質の生合成経路とオルガネラ間の移動
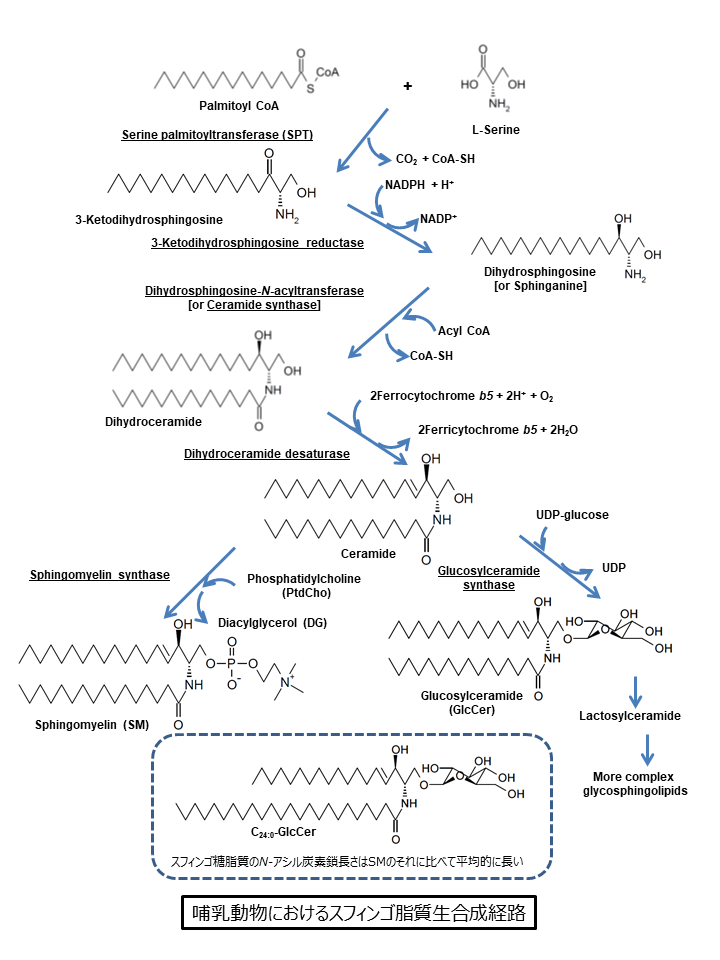
スフィンゴ脂質の生合成では、セリンパルミトイル転移酵素(serine palmitoyltransferase;SPT)が触媒するセリンとパルミトイル palmitoyl CoAとの縮合反応からはじまり、いくつかの反応を経てセラミドとなります(図2)[5, 6]。哺乳動物細胞においては、セラミドはさらにスフィンゴミエリンsphingomyelinもしくはグルコシルセラミドglucosylceramideへと変換され、グルコシルセラミドはさらに複雑なスフィンゴ糖脂質へと変換されます(図2)。この際、セラミド合成までは小胞体膜上の細胞質側の表面でおこりますが、 スフィンゴミエリンやスフィンゴ糖脂質の合成はゴルジ体でおこると考えられています。したがって、スフィンゴミエリン合成の際には、セラミドは小胞体からゴルジ体に移動しなければならないはずです(図1)。

図2
なお、グルコシルセラミド合成でもセラミドのゴルジ体への移行が必要と考えられておりますが、グルコシルセラミド合成酵素glucosylceramide synthaseの一部分は小胞体にも分布しているという報告もあり[7, 8]、グルコシルセラミドの新合成が小胞体上でおこっている可能性もあります。その場合、グルコシルセラミドがさらに複雑なスフィンゴ糖脂質へと変換するために、グルコシルセラミド分子はゴルジ体に移動するはずです。グルコシルセラミドのおもな合成の場所、そこへのセラミドの分配やグルコシルセラミド分子が次の代謝の場へ移動するメカニズムは本稿を書いている2013年の時点でもよくわかっておりません。
4.細胞内セラミド輸送が欠損している突然変異細胞株
縞ミミズEisenia foetida(釣り餌やミミズコンポストの用途で使われる細いミミズです)の体腔液からもともとは血管収縮を誘導する作用のある物質として分離され、そののちに、細胞表面上のスフィンゴミエリンに結合して膜に孔をあける細胞溶解活性のあることが判明したタンパク質がライセニンlyseninです。ライセニンは、その精製と遺伝子クローニングから蛍光プローブをつけた誘導体作製にいたるまでおもな研究成果を日本の研究グループが挙げ世界に広がっています[9-12]。
1996年のはじめころ、梅田真郷先生(当時の所属は東京都臨床研、現在は京大院・教授)から、「スフィンゴミエリン結合能と細胞溶解活性があるタンパク質(その当時はeiseninという名でよばれていた)をみつけたが、スフィンゴミエリン分解活性があるかどうかを測定してほしい」との依頼をうけました。私たちにはスフィンゴミエリン分解酵素の活性測定系がありましたので、いただいたサンプルで測定したところ、そのような活性はありませんでした。このタンパクにさらすと、正常細胞は速やかに死滅しましたが、私たちで分離したスフィンゴ脂質全般の合成を失った変異細胞はすべて生き残ることを観察しました[13]。さらに、正常細胞であっても、精製したスフィンゴミエリン分解酵素で処理すれば、ライセニンに耐性となることもみつけました[13]。これらの観察から、ライセニンはスフィンゴミエリンを分解して細胞を殺すのではなく、膜に孔を開けて細胞を溶解させるpore-forming cytolysinの一種であり、膜に結合するにはスフィンゴミエリンが必要なのだということが確認できました。
そこで、「ライセニンで処理をしても生き残る」という簡便な選択方法によってスフィンゴミエリン代謝に異常がある新しい変異株を得られるのではなかろうかと期待し、チャイニーズハムスター卵巣から樹立された培養細胞であるCHO-K1細胞を親株として、ライセニン耐性を示す変異株を40 株ほど分離しました。その際に得た変異株の一つが、LY-A株と名付けた変異株です[13]。(章末の余談1も参照)
LY-A細胞では、 スフィンゴミエリンの新合成de novo synthesisの速度および含有量がともに低下しているものの、スフィンゴミエリン代謝に関する酵素活性には異常は認められず、脂質輸送の段階に欠損があるのではないかと疑われました。当時、小胞体からゴルジ体へとセラミドを輸送する活性を検出する実験手法はなかったため、以下のように自分たちで模索した検証方法によって、この疑問に答えました。
ブレフェルジンA (brefeldin A, BFA)という薬剤で細胞を処理すると、小胞体とゴルジ体とが融合することが知られています。もし、小胞体とゴルジ体のあいだのセラミド輸送の異常によりスフィンゴミエリン合成が低下しているのなら、BFA処理で小胞体とゴルジ体を融合させてしまえば、スフィンゴミエリン合成の低下はもはやみられなくなるであろうと予測されます。実際にやってみるとこの予想とおりになり、BFA 処理後のスフィンゴミエリン合成はLY-A細胞と親株CHO-K1細胞とのあいだでほぼ等しくなりました[14]。この観察により、私たちは、LY-A細胞でもスフィンゴミエリンを合成する酵素はちゃんと機能しており、小胞体で合成されたセラミドがスフィンゴミエリンへ変換するゴルジ体へ移動するプロセスに異常がおきているらしいことを知ることができたわけです。このことをさらに別の実験でも検証しました。
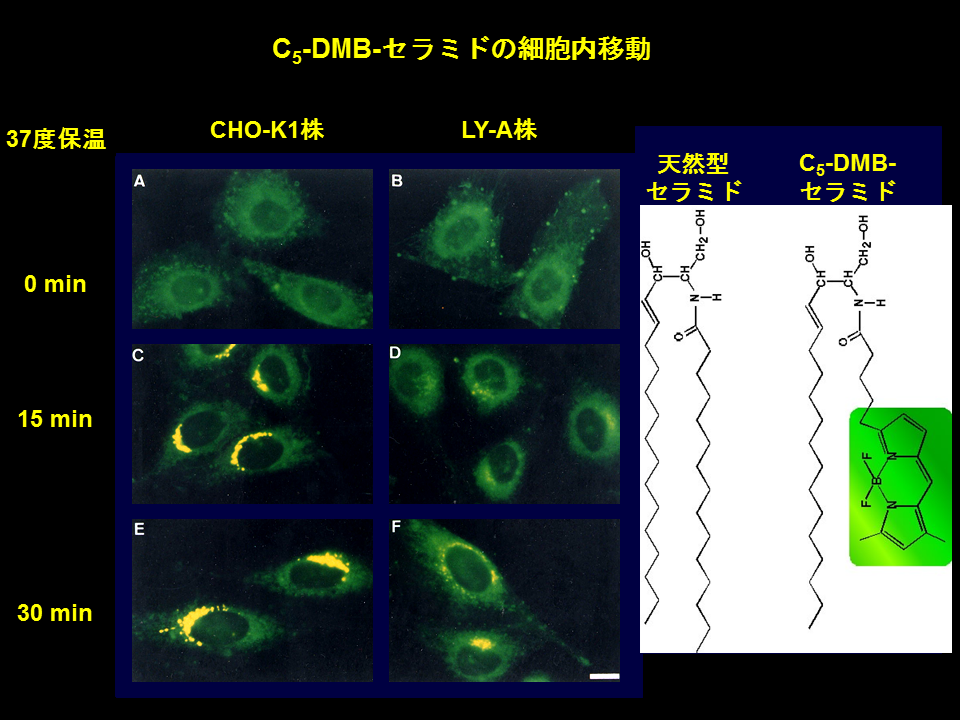
C5-DMB-セラミドは、蛍光団をもった人工のセラミド類似化合物です(図3)。細胞を低温でC5-DMB-セラミドにさらすと、この化合物は形質膜を通過し、細胞中のオルガネラ膜を蛍光標識します。この標識細胞を生理的な温度にもどすと、蛍光がゴルジ体領域に集まってくることが知られており、この現象は小胞体で合成された天然型セラミドがゴルジ体へと移動することを反映したものであろうと推定されていました[15]。親株とLY-A株でC5-DMB-セラミドをもちいたそのような実験を行うと、ゴルジ体領域への蛍光の集積がLY-A株では遅くなっていることが観察されました(図3)[14]。
図3
これらの結果から、私たちは、セラミドの小胞体からゴルジ体への移行がLY-A株では欠損していると結論しました[14]。
5.セラミド選別輸送の再構成実験系の樹立
ものごとをいちど分解してからそれを再構築してみることは、ものごとの仕組みを知るうえでとても有効です。細胞のなかでおきている脂質輸送という仕組みを知りたいのであれば、細胞を分解しつつも生細胞のなかでおきているその事象のすべてではないにせよその重要な一部分を再現できる実験系を編み出すことは、研究を飛躍させるためには是非とも越したい大きな関門であります。
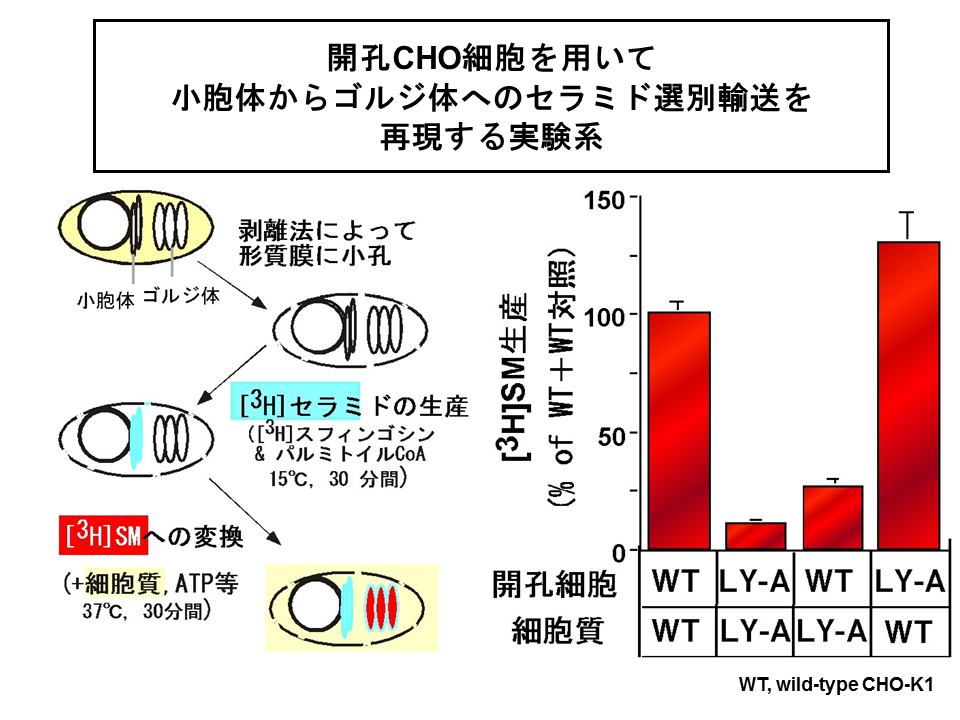
私たちは、小胞体からゴルジ体へのセラミド輸送を生細胞以外で観察できるようにすることに挑戦しました。そして、セラミド→スフィンゴミエリン変換の速度、温度依存性、そして親株CHO-K1細胞と変異株LY-A細胞との差といったさまざまな点において無傷の細胞で観察される事象をよく再現する再構成系reconstitution systemを樹立することができました[16]。
この実験系では、形質膜に小孔をあけて細胞質cytosolを抜いてしまった開孔細胞中で放射性同位体で標識された[3H]セラミドを合成させたのち、細胞質画分やATPを加えて、37℃で保温します(図4)。37℃で保温時の[3H]セラミドから[3H]スフィンゴミエリンへの変換が、小胞体-ゴルジ体間セラミド輸送の指標となります。
この再構成実験系において、セラミド→スフィンゴミエリン変換は細胞質の添加を必要としました。さらに、LY-A細胞の再構成では欠損しているセラミド→スフィンゴミエリン変換は、細胞質画分だけでも親株由来のものに交換すると回復することから(図4)、セラミド輸送にかかわる細胞質因子がLY-A細胞では欠損していることがわかりました[16]。スフィンゴミエリン合成酵素sphingomyelin synthase活性には、細胞質依存性はありませんでしたし、タンパク質の小胞体からゴルジ体への輸送はLY-A細胞でも正常であったので、LY-A細胞で欠損しているのは、セラミド輸送に特別に必要な遺伝子産物であると考えられました[14]。
図4
自分たちで分離していた変異株LY-Aの存在が、この再構成実験系を樹立するうえでとても重要でした。私たちはもともと、「親株CKO-K1細胞と変異株LY-A細胞との差が再現できる」ということを再構成が成功したと判断する一番目の基準としておりました。よって、なにかしらのシグナルは検出できても、この基準に合わずに捨て去られた試作系もあります。そもそも、分子メカニズムがわかっていない生物学的事象の再構成などという不遜な企ては、適切な評価系がなければすぐにでも間違った道に迷い込んでしまうものなのです。私たちは、LY-A細胞のおかげで、自分たちが試作した実験系をそのつどに評価しながら信頼のおける再構成系へと到達することができたといえます。このセラミド選別輸送の再構成系は、そののちもいろいろな場面で活躍しています。
次いで、 LY-A株の欠損因子の同定を試みました(本当は、「次いで」ではありません。遺伝子クローニングは変異株がとれてまもない1998年中にはすでに挑戦しはじめており、再構成系の作製などと一緒に同時並行的に試行錯誤していたのが実状です)。
6.LY-A株を回復させる遺伝子cDNAのクローニング
6−1.回復株を選択するための条件さがし
LY-A株と親株CHO-K1細胞との融合させた細胞におけるスフィンゴミエリン合成は、CHO-K1細胞のそれとほぼおなじでした。この観察の意味するところは、「LY-A細胞におきている遺伝子変異は正常な遺伝子とおなじ細胞中で共存した場合には、細胞が正常な性質を表すような変異である(このような変異を「劣性変異」とよびます)」ということです。であるのならば、LY-A細胞に正常型の遺伝子すべてをひとつずつLY-A細胞に発現させていけばどこかでLY-A細胞の欠損を回復させる遺伝子に行きつくはずです。それには、数万種類以上の遺伝子を導入したLY-A細胞集団から回復細胞をうまく選びだせるかどうかがキーポイントになります。しかし、ライセニン感受性にもどった細胞をライセニン処理したのちに選択するというやりかたでは、選択したい回復細胞をライセニン処理中に殺してしてしまい細胞を回収できないため使えません。私たちが前に進むには、「LY-A細胞は死滅させるが回復株は生き残る」という選択条件をあらたにみいだす必要がありました。
スフィンゴミエリンとコレステロールは、ともに形質膜におもに分布しています。そして、人工脂質膜をもちいた実験から、コレステロールはグリセロリン脂質glycerophospholipidsに比べてスフィンゴミエリンとより強い物理的相互作用をすることが知られていました。私たちは、コレステロール結合試薬・メチルシクロデキストリンmethyl-beta-cyclodextrinに細胞をさらした場合、LY-A細胞のようなスフィンゴミエリン含有量の低い細胞ほどコレステロールが速やかに失われて死滅することをみいだしました[17]。これで、LY-A細胞に外来遺伝子を導入したあとにメチルシクロデキストリン処理し、生き残った細胞から外来遺伝子を回収するという方向性でLY-A細胞で欠損している遺伝子を探しだす道が開けました。
実際には、効率的なレトロウイルスベクター系を利用するなどのさらなる工夫が必要でした。安定かつ効率的な遺伝子導入に使うことができるマウス欠損レトロウイルスにCHO細胞は感染しません。その受容体がないからです。そこで、当該ウイルスの受容体であるマウス・カチオニック・アミノ酸トランスポーター1(mouse cationic amino acid transporter 1; mCAT-1)をLY-A株に安定発現させたLY-A亜株を作製し、それにレトロウイルスベクター上に構築したヒトcDNAライブラリー(これは市販のものを利用しました)から調製したウイルス粒子を感染させるという方法へと切りかえるまで目的遺伝子にはたどり着けませんでした。このとき、東京大学医科学研究所の北村教授らによって開発されたレトロウイルス粒子生産用パッケージ細胞Plat-Eを使わせていただけたことは幸いでした。
6−2.LY-A株で欠損している遺伝子の同定
遺伝子導入の工夫とみいだした選択条件をもちいて、私たちはLY-A株の欠損を補う遺伝子cDNAをクローニングすることに成功しました[18]。本cDNAをLY-A株に導入すると、しらべた範囲内ですべての性質が親株CHO-K1細胞のレベルに回復しましたので、この遺伝子cDNAがコードするタンパク質はceramide traffickingにちなんでCERTと命名することにしました[18]。
LY-A細胞のCERT遺伝子にはアミノ酸変異をともなう一塩基置換変異が起こっており、この変異型CERT cDNAの導入ではLY-A細胞はちゃんと回復できないこともわかりました[18]。
LY-A細胞を見かけ上でも回復させるようなCERT以外の分子を見つけられないかと、上記のスクリーニングをCERT発見のあとも繰り返したのですが、もう一度CERT cDNAがクローニングされただけに終わりました。はからずもこのスクリーニング系の「再現性」を確認してしまったことになります。
6−3.CERTとおなじ遺伝子産物GPBPΔ26
CERTとアミノ酸配列がおなじ遺伝子産物は、Goodpasture-antigen binding protein (GPBP)のスプライス異性体splice variantであるGPBPΔ26という名ですでに知られていました。
グッドパスチャー症候群Goodpasture’s syndromeというのは腎臓や肺の基底膜に対する自己抗体ができて死にもいたる重篤な自己免疫疾患です。この自己免疫疾患の抗原すなわちグッドパスチャー抗原Goodpasture antigenは、ヒト・4型コラーゲン・アルファ第3アイソフォーム(Type 4, collagen alfa3; COL4A3)のカルボキシル末端にある非コラーゲン部分であることが知られています。このCOL4A3の非コラーゲン部分に結合してこれをリン酸化するタンパク質キナーゼとしてGPBPおよびGPBPΔ26(GPBPのエキソン一つ分の26アミノ酸がないスプライス異性体)をスペインのSaus博士らの研究グループが報告していたのです[19, 20]。(章末の余談2も参照)
GPBPおよびGPBPΔ26は、グッドパスチャー症候群という病的な状態に関わるかもしれない細胞外キナーゼとして報告されていますが、通常のタンパク質キナーゼならもつようなキナーゼドメインがみあたりません[19, 20]。また、これらのタンパク質は、明瞭な分泌シグナル配列がなくて細胞質に多く分布するというのにもかかわらず、細胞外マトリックスであるコラーゲンに結合するということも不思議な観察であり、健常なヒトにおいては細胞内での役割が本業である可能性もありました。
私たちは、次の項で説明するように、このタンパク質の本来の役割は細胞内のセラミド輸送であることをみいだしたので、名が体をあらわすべくCERTという新しい名前をGPBPΔ26に与えました。GPBP(CERTのlarge variantということでCERTLと私たちはよんでいます)も、セラミド転移活性はCERTとおなじように観察されています[18]。(章末の余談3も参照)
なお、ヒトゲノム遺伝子として最初に登録された名称は、Collagen type 4 alfa 3-binding proteinとしてみつかったGPBPに由来するCOL4A3BPですので、CERT配列を各種生物ゲノムでホモロジー検索するとヒトCOL4A3BPホモログとして表示されます。セラミド輸送も注釈としてついておりますが。
その後、本遺伝子は、コラーゲン結合因子というよりもセラミド輸送タンパク質として様々な研究者に引用されました。その事情を察知したHuman Genome Organization (HUGO)のGene Momenclature Committee (HGNC)は、このヒト遺伝子の正式なシンボルをCERT1 に変更すると2019年6月に決定しました。それ以降、NBCI上での正式命名表示(https://www.ncbi.nlm.nih.gov/gene?Db=gene&Cmd=DetailsSearch&Term=10087)も含めてCERT1へと変更されてきています。
7.小胞体からゴルジ体へのセラミドの選別輸送を担う分子装置CERT
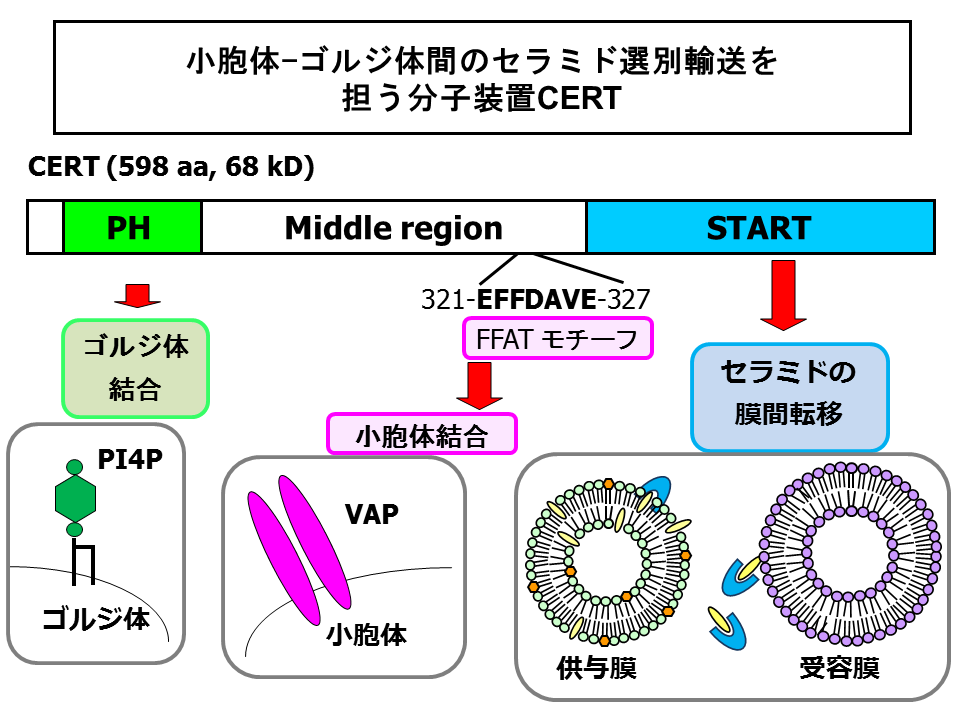
CERTは、68 kDaの親水性タンパク質であり、そのほとんどは細胞質に分布しますが、一部はゴルジ体にも会合しています[18] 。CERTを解析すると、複数の機能領域をもつことでセラミドの小胞体からゴルジ体への選別輸送を自身で担えるようなタンパク質であることがあきらかとなってきました(図5)[18, 21, 22]。
図5
7−1.ゴルジ体へのターゲットに必要なPHドメイン
CERTのアミノ末端領域の約100アミノ酸は、リン酸化イノシトール脂質phosphoinositidesを結合するプレクストリン相同pleckstrin homology (PH)ドメインを形成しています。このPHドメインは、さまざまなリン酸化イノシトール脂質のなかで、ホスファチジルイノシトール-4-一リン酸phosphatidylinositol-4-monophosphate (PtdIns4P, PI4P)を特異的に結合しました[18]。PtdIns4Pは細胞内では主にゴルジ体およびトランスゴルジ網trans Golgi networkに分布しており、PtdIns4Pを特異的に結合するPHドメインはゴルジ体へのターゲットシグナルとして働きます[23, 24]。
LY-A細胞と親株のCHO-K1細胞からそれぞれ内在性CERTのcDNAをクローニングして比べたところ、PHドメイン内のグリシン残基がLY-A株由来CERTではグルタミン酸に置換(G67E変異)されていました。この置換のため、LY-A株由来のCERTはPtdIns4P結合能を失い、それが原因でゴルジ体到達能も失っていました[18]。
2012年にCERTのPHドメインの三次元構造が解かれ、このPHドメインがゴルジ膜を選択的に認識できる仕組みがさらにわかってきています[24](この紹介は別途してゆきたいと思います)(簡単な紹介はこちら)。
7−2.セラミドの引き抜き転移活性をもつSTARTドメイン
CERTのカルボキシル末端領域の約230アミノ酸は、膜のあいだの脂質の転移をおこなうと推測されるSTARTドメインを形成しています[25]。人工のリン脂質膜をもちいた実験から、CERTのSTARTドメインは、膜からセラミドを特異的に引き抜き、1:1複合体を形成し、結合したセラミド分子を別の膜に移す活性をもつことがあきらかになりました[18, 21]。CERTのSTARTドメインは、セラミドに対して選択性が高く、スフィンゴシンやスフィンゴミエリンの転移活性はまったくありませんでした。セラミドに化学構造が比較的似ているジアシルグリセロールdiacylglycerolの膜間転移の活性でも、セラミドに対する活性の5%くらいでしかありませんでした[18, 21]。私たちは、哺乳動物細胞における典型的な天然セラミド分子である(アミド結合脂肪酸がC16パルミチン酸の)C16-セラミドをもちいて通常は解析していますが、C16-セラミドの天然にある異性体分子(ジヒドロセラミドdihydroceramideやフィトセラミドphytoceramide)や脂肪酸鎖長さの違ういろいろなセラミド分子もC16-セラミドとおなじように転移させることも観察しています[21]。
このような基質認識の特異性と融通性とを併せもつ仕組みも、CERTのSTARTドメインとセラミドとの共結晶の解析によって、原子レベルでわかってきています[26-28](これについての紹介も別途する予定です)。
7−3.小胞体との相互作用にかかわるFFATモチーフ
PHドメインとSTARTドメインのあいだの約260アミノ酸からなる中間領域(middle region; MR)は、既知のドメインには該当するものがありません。しかし、小胞体膜タンパク質であるVAPに結合すると報告されたペプチドモチーフ(FFATモチーフと名付けられている)が存在しています[29](図5)。CERTはこのFFATモチーフに依存してVAPに結合すること、そして、FFATに変異がおきると、CERTの小胞体-ゴルジ体セラミド輸送機能がそこなわれることがわかりました[22]。
8.小胞体からゴルジ体へのセラミドの選別輸送のメカニズム
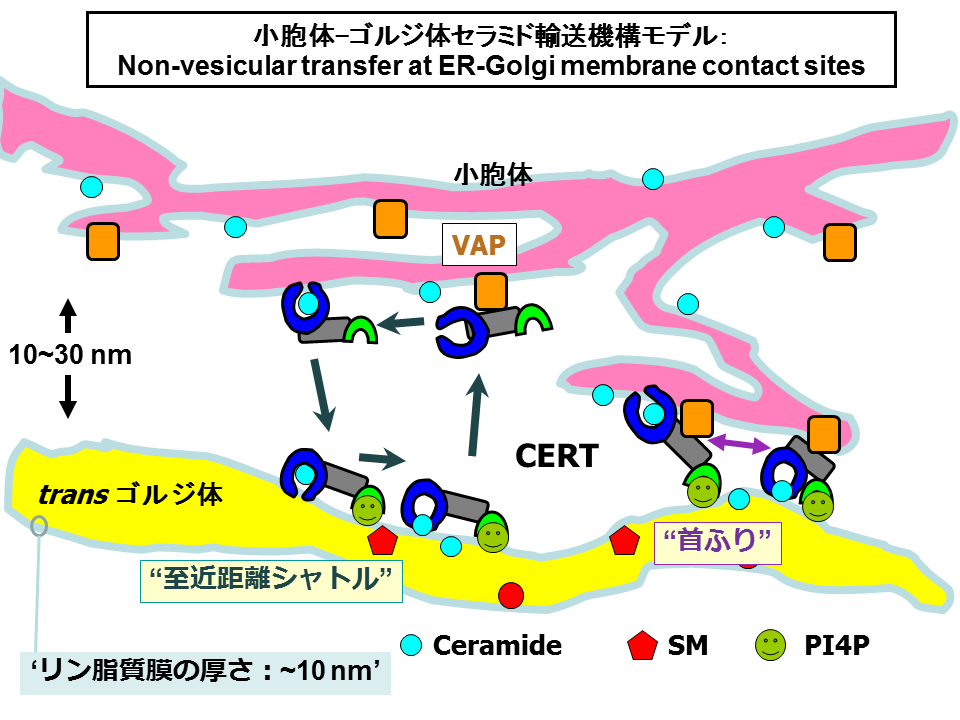
上で述べたような実験結果から、CERTは小胞体からゴルジ体へとセラミドを輸送する分子であると私たちは結論し、その分子メカニズムとして「脂質分子引き抜き転移モデル」を提唱しました(図6)[30-33]。
このモデルでは、つぎのような素過程の繰り返しでセラミドが運ばれるとしています: (1) CERTがVAPとの相互作用を介して小胞体と一時的に会合し、(2) 小胞体膜から特異的にセラミドを引き抜いて、CERT/セラミド1:1複合体を形成する、(3) CERT/セラミド複合体は、小胞体からPtdIns4Pの豊富なゴルジ体領域に選択的に到達し、(4)セラミドをゴルジ体膜へ受けわたし、そして、(5)はじめのステップ(1)に戻る。
図6
CERTを発見した当初から予想されていることですが、CERTが介するセラミドの小胞体からの引き抜きとゴルジ体への転移は、小胞体全体で均質におこっているというよりも、小胞体とゴルジ体が近接した特別な領域でおこっているようです。
小胞体の英語であるendoplasmic reticulumを直訳すると「細胞(質)内の網目構造体」となります。小胞体は、その名の通り細胞質全体に網目のように広がる膜構造であることから、ほかのオルガネラに近接しうると想像されます。実際、小胞体の一部分は、偶然にほかのオルガネラと近接するにとどまらず、(タンパク質のサイズレベルである)10-30 nmくらいの距離で接触していることがいろいろな細胞でしめされております[34, 35]。ゴルジ体膜との接触にかんしては、ゴルジ体のなかのトランス嚢trans cisternaが特異的に小胞体と接触していると考えられています[36]。
このようなオルガネラ膜接触部位organelle membrane contact sitesがになう役割についていくつかの事柄が提唱されており、そのなかでも脂質やカルシウムイオンなど低分子のオルガネラ間移動へのかかわりが特に注目されています[34, 37-39]。
もし、出発地と到着地が近接した小胞体-ゴルジ体接触部位でセラミドの引き抜き転移がおこるのであれば、素早いシャトルが可能になるでしょう(図6)。CERTは両方の膜に同時に結合しながらSTARTドメインを首振り運動のように動かし、セラミドを小胞体から引き抜いて、ゴルジ体へと移しているのかもしれません(図6)。
CERTとVAPをおなじ細胞中で高レベル発現させて細胞内分布を観察すると、CERTの濃縮するゴルジ体領域にVAPもわずかながら共局在co-localizationされるように観察されます[22]。VAP結合能をうしなったCERT変異体をもちいた場合ではCERTはゴルジ体領域に濃縮されながらもVAPの共局在はおきません[22]。これらの観察は、PHドメインを介してゴルジ体と結合しているCERTは、自身のもつFFATモチーフをもちいて小胞体のVAPとも同時に結合しうることを示唆しています。このことは、図6のような小胞体-ゴルジ体接触部位でCERTが働くとするモデルを支持する結果といえます。
ゴルジ体領域においてグルコシルセラミド合成酵素は、スフィンゴミエリン合成酵素よりもシス側(小胞体からのタンパク質輸送の入り口に近い方)に存在しているので、タンパク質輸送とおなじ経路でセラミドが運ばれているのなら、小胞体で合成されたセラミドはグルコシルセラミド合成酵素に先に到達してそこで優先的に使われてしまうと想像されます。しかし、実際のスフィンゴ脂質生合成では、糖脂質よりもスフィンゴミエリンの合成により多くのセラミドが消費されています。上で紹介した分子引き抜き転移モデルに立てば、 CERTを介して小胞体から移動するセラミド分子は、シスゴルジ領域のグルコシルセラミド合成部位を飛び越えて、ゴルジ体トランス領域にあるスフィンゴミエリン合成の場へと到達すると説明することができます。
9.CERT機能の制御機構
9−1.CERTの多重リン酸化領域SRMとそのリン酸化による負の制御
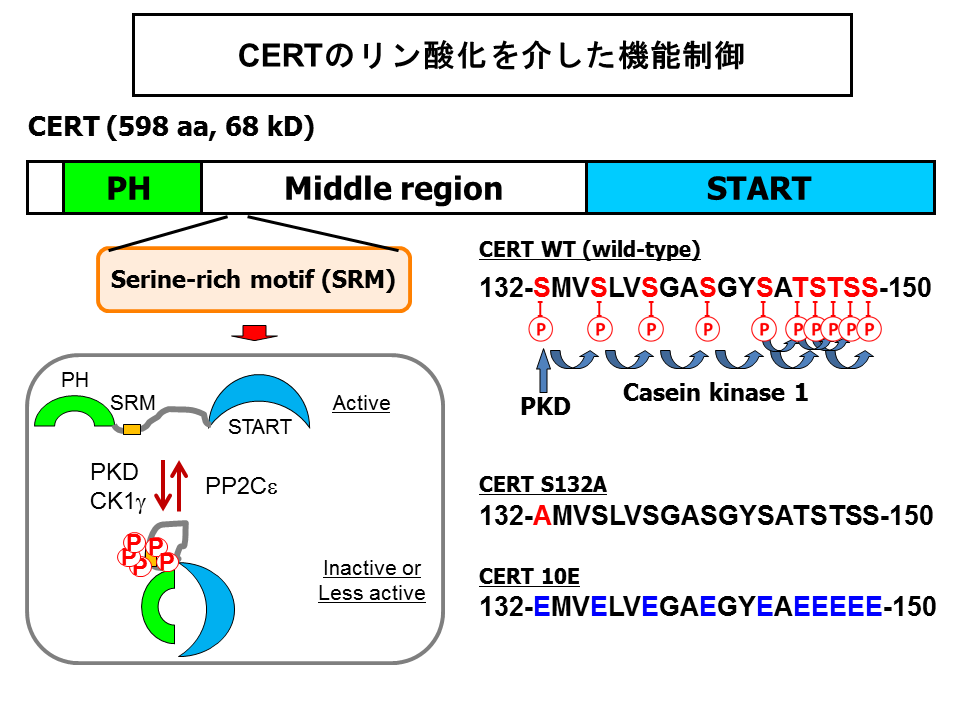
抗原ペプチド配列を付けたCERTを培養細胞に発現させて、ウエスタンブロット解析するとポリアクリルアミドゲル電気泳動で分離できる程度に位置がずれた二重のバンドとして検出されます。細胞破砕液をタンパク質脱リン酸化酵素処理するとこの二重バンドは一つのバンドに収束することから、CERTはリン酸化修飾を受けると考えられました。そこで、ヒト子宮頸ガン由来株化HeLa-S3細胞に抗原ペプチド配列を付加したCERTを発現させて、それを抗体クロマトグラフィー法で精製し、定法に従って質量分析したところ、約30アミノ酸の長さの配列中に10個あるセリン・スレオニンのすべてがリン酸化されている領域をみつけ、この多重リン酸化領域をserine repeat motif (SRM)と名付けました(図7)[40]。
SRMにあるセリン・スレオニン10個すべてをグルタミン酸に置換した疑似多重リン酸化変異体・CERT 10Eおよび当該領域がリン酸化されないような変異体・CERT S132Aと野生型CERTとを比べたところ、
i) 小胞体からゴルジ体へのセラミド輸送能においてCERT 10Eはほとんど活性を示さず、逆に CERT S132Aは野生型CERTよりも高い活性がある、ii) CERTのアミノ末端領域にあるPHドメインの活性(すなわちPtdIns4P結合活性)とカルボキシル末端領域にあるSTARTドメインの活性(すなわちセラミド転移活性)の両方がCERT 10E変異体では低下しており、逆にCERT S132Aでは高進していることがわかりました。さらに、CERT 10EのPHドメインのみを切り離すとSTARTドメイン活性が回復し、逆にSTARTドメインのみを切り離すとPHドメイン活性が回復しました[40]。
これらの観察をもとにして次のようなモデルを提案しました(図7)。すなわち、SRMが多重リン酸化すると、CERTがコンフォメーション変化をおこして、PHドメインとSTARTドメインがお互いをマスクするようになって両方のドメイン活性が抑制されるというものです[40]。
SRMのリン酸化状態は、スフィンゴ脂質合成を阻害したり、スフィンゴミエリンを強制的に分解したりすると脱リン酸化の方向に変化しました[40]。細胞のコレステロールを減らすような処理をしてもおなじように脱リン酸化傾向にありました[40]。これらの観察は、スフィンゴミエリンとコレステロールが共同して形成している生体膜の環境が破壊されるとCERTのSRMが脱リン酸化されて、CERTの機能としては高進する(スフィンゴミエリンをより多く合成する)ように仕組まれていると解釈できますものの、どのようにしてそのような一連の反応がおこるかのメカニズムはまだわかりません。
図7
ほぼ同時期に海外のグループからも、CERTのS132がタンパク質リン酸化酵素D (protein kinase D; PKD)によってリン酸化されるとCERTのPtdIns4P結合活性とセラミド転移活性の両方が低下するという論文が出ています[41]。CERTの似たような解析をしているほかのグループがいたことに驚かされました。この研究グループは、PKDのゴルジ体へのかかわりを中心に調べているグループであり、PKDの認識部位になりそうなCERTのS132に注目した参入だったようです。
ちなみに、HeLa細胞に発現させた野生型CERTは細胞質とゴルジ体領域の両方に分布しますが、常時活性型constitutive active formともいえるCERT S132A変異体はゴルジ体領域に局在するようになります。常時不活性constitutive inactive(または低活性)型であるCERT 10Eはゴルジ体への分布がほぼ消滅します[40]。これらの観察は、活性型CERTはゴルジ体領域に局在しながら働いていることを示唆しており、小胞体-ゴルジ体膜接触部位がCERTの働く場であることを支持する観察と私たちは考えています。
9−2.CERT SRMの多重リン酸化に関与するキナーゼの同定
スフィンゴミエリン合成を抑制するような因子を知りたいと、遺伝子を過剰発現するとスフィンゴミエリン結合性の細胞融解毒ライセニンに対して耐性を与えるcDNAをスクリーニングし、細胞内のおもなリン酸化酵素のひとつであるカゼインキナーゼ1ガンマ2(casein kinase 1 gamma 2; CK1g2)によってスフィンゴミエリン生合成が抑制されることを私たちはみいだしました[42]。その際、スフィンゴミエリン合成酵素活性は影響を受けていませんでした。カゼインキナーゼ1はアミノ酸2-3個おきに並ぶセリン・スレオニンを連続的にリン酸化する酵素です。結局、CK1g2は上で述べたCERTの多重リン酸化領域SRMをリン酸化することでCERT活性を抑制することがあきらかとなりました(図7)[42]。
9−3.CERTの脱リン酸化に関与する酵素
タンパク質脱リン酸化酵素protein phosphataseの研究で著名な東北大の小林先生・田村先生たちのグループは、Protein phosphatase 2C epsilon (PP2Ce)と結合するタンパク質の一つとしてVAPがあることをまずみいだし、さらに、VAPと会合することがあるCERTの脱リン酸化にPP2Ceかかかわっていることもしめしました(図7)[43]。これには私たちも共同研究として参画させていただきました。
9−4.CERT S315のリン酸化とVAPとの会合
SRM以外の箇所でもCERTはリン酸化を受けており、それも機能制御に重要であることも明らかになりました。タンパク質の質量分析の発展はすさまじく、2000年代中盤には細胞中のタンパク質のリン酸化部位を網羅的に同定するということが可能になってきました。Olsenらは上皮成長因子epidermal growth factor (EGF)刺激がもたらすタンパク質リン酸化ネットワークを知るため、HeLa細胞をEGF刺激して後経時的にリン酸化ペプチド断片を約2000のタンパク質を網羅しながら解析しました[61]。その論文データの中にCERTの315番目のアミノ酸残基であるセリン315 (S315)がリン酸化を受けている実証的証拠が記載されていました[61]。S315はFFATモチーフのすぐ上流にあります。我々は、S315のリン酸化がFFATモチーフの機能に影響するという作業仮説を立て、S315リン酸化型CERTに対する抗体やCERTの各種アミノ酸変異体を用いて解析を行いました。その結果、S315がリン酸化するとCERTのFFATモチーフ依存性のVAP結合活性が顕著に増強することを通じて、CERTのセラミドの小胞体-ゴルジ体間輸送機能も高進することを見出しました[62] (簡単な説明はこちら)。S315のリン酸化はPHドメインが担うPtdIns4P結合能やSTARTドメインの担うセラミド転移活性にはほとんど影響を及ぼさず、SRMのリン酸化・脱リン酸化とS315のリン酸化・脱リン酸化は独立に起こることができて、それぞれ相加的にCERT機能を制御しうることを明らかにしました[62]。CERT S315のリン酸化・脱リン酸化を司るキナーゼ・ホスファターゼはまだ同定されていないものの、SRMを含むこれら一連の研究の結果は、CERTが複数のキナーゼ・ホスファターゼ系で制御されていることを示しております[62]。
脂質を転移するタンパク質lipid transfer proteins (LTPs)には今や少なくとも7つのファミリーとそれらの多くのメンバーが見つかっておりますが、CERTは機能の点からだけでなく制御の点においてもその分子メカニズムの解析が(今のところ)他を先んじており、LTPs研究の重要なモデル系と目されていると思われます。
10.CERTがかかわるそのほかの最近の情報
抗癌剤への耐性はガン治療における大きな障害のひとつです。興味深いことに、CERT活性を阻害するといろいろな抗癌剤耐性が解除される(薬剤が効くようになる)ことが培養細胞レベルでしめされました[44, 45]。この現象には、小胞体で合成されたセラミドの代謝不全が細胞へあたえるストレスがかかわっていると推察されています[44, 45]。
モノクローナル抗体医薬などの生物医薬品は、 CHO細胞などの培養細胞で組換え体として生産させたものを原料としている例が多数あります。よって、目的の組換え体タンパク質を効率的に細胞培養液中に放出させることは、生物医薬品の生産性の向上につながるので、とくに製薬企業の生産現場では大切な課題となっています。上で紹介したCERT S132A活性化変異体をCHO細胞に発現させるなどしてCERT機能を高進させると、モノクローナル抗体の生産性が二倍以上になるそうです[46]。スフィンゴミエリンの合成はゴルジ体のタンパク質分泌能におそらく重要ですので[41, 47]、CERT機能の増強によりスフィンゴミエリンの合成が高まり、その結果、ゴルジ体の分泌機能が高まったのかもしれません。
膜接触部位における分子引き抜き転移は、真核細胞における脂質合成などの生理的反応だけでなく、宿主細胞に寄生したウイルスや細菌が宿主由来の栄養素などを奪う病理的反応にもかかわっているらしいことも、あきらかになりつつあります[48-50]。
病原体とCERTとのかかわりで、私たちがとくに注目しているのは、宿主細胞のなかでしか増えることができない偏性寄生細菌のクラミジア菌です。クラミジア菌の増殖には宿主細胞のスフィンゴ脂質が必要であると、10年以上も前に報告されていました[51]。そして、2011年に、クラミジア菌は宿主細胞の合成するセラミドを利用しており、そのさいにCERTをハイジャックしているらしいこと、それも菌の住む寄生胞と宿主細胞の小胞体との間の膜接触部位でセラミドが運ばれているらしいという報告が、二つの研究グループからおなじ雑誌のおなじ号に発表されました[48, 49]。(そのひとつに私は共同研究者として関わっています。簡単な紹介はこちら)
クラミジア・トラコマスChlamydia trachomatisは、日本など多くの先進国において性感染症(sexually transmitted diseases; STD)の最大起因病原体ですし、開発途上国ではこの菌が目に感染しておこる結膜炎を完治できずに繰り返す炎症による視力喪失がおおきな公衆衛生上の問題となっています。クラミジア菌の基礎研究は研究者人口もあまり多くないようですので、私たちが提供できる宿主細胞側の実験材料やアプローチ方法により微力ながらも貢献したいと考えております。
私たち以外の研究グループからもCERT/GPBPΔ26に関する論文は遺伝子破壊動物の解析結果なども含めてかなりの数が出てきており、CERTが細胞内セラミド輸送に関与することは広く認知されてきました。私たちがCERTを発見した2003年の原著論文を引用している論文数は、私たちが共著者である論文を除いても、たとえば下の引用文献リストの[52]-[57]など、400を越えています。
ただし、GPBP/CERTLは細胞外に分泌されていろいろな細胞外マトリックスと結合するという報告もありますので[58-60]、GPBP/CERTLには細胞外での役割もあるのかもしれません。また、Saus博士らの報告が主張するようにGPBPやGPBPΔ26(つまりCERT)にキナーゼ活性があるとしても、このタンパク質のどの部分にキナーゼ領域があるのかは未解決です。
TALEN法やCRISPR/Cas9法の開発により、哺乳類の培養細胞においても目的の遺伝子を簡単に欠失させることが可能な時代がついに到来しました。長らく哺乳動物培養細胞を実験材料に用いて研究を行っている私にとっても、このようなゲノム編集技術は「こんな方法があったらよいのに」と思い描いていた正に夢の技術です。2011年(平成23年)9月に開催された生化学会のランチョンセミナーでTALEN法の紹介があり、すぐさま飛びついてHeLa細胞への応用を試みました。いろいろな”初期不良“を克服することで、疑似3倍体のHeLa細胞でも三つのCERT対立遺伝子座全てをノックアウトすることに成功しました[63]。目的とするゲノム遺伝子の配列やexon構造で難易はあるものの、基本的に試みた全ての遺伝子でノックアウトは成功し、グルコシルセラミド合成酵素遺伝子とCERT遺伝子の両方を欠損させた二重変異HeLa細胞の作出もできています[63]。ここで構築した細胞パネルは今後のスフィンゴ脂質研究に大いに役立つでありましょう(簡単な説明はこちら)。
この節で紹介したように、私たち自身でさえ予想もできなかった方面にもCERTがインパクトをおよぼしつつあるようです。応用面も含めたいろいろなことにCERTの研究が役立つというのは、研究者冥利でもあり、ありがたく思います。
11.今後の研究の展望
生体膜は、タンパク質と脂質とをそのおもな成分としています。膜タンパク質の細胞内輸送に関わる分子群はすでに数多くみつかっており、粗面小胞体で合成された膜タンパク質がほかのオルガネラへと運ばれるのは輸送小胞を利用したメカニズムによることがあきらかになっています。一方、小胞体(おそらく滑面小胞体)で合成された膜脂質の選別輸送メカニズムは、CERTの発見やオルガネラ膜接触部位の存在の再認識をきっかけとして、「分子引き抜き転移」というまったく別のメカニズムで語られつつあります。
私(花田)にとって、CERTの研究は(たとえ細々とでも)かならず継続してゆきたいテーマです。今後は、CERT機能の制御のメカニズムをさらにあきらかにするだけでなく、CERTがかかわって膜接触部位がかたちづくられる可能性の検証もしてゆきたいと考えております。
余談1
いま思いかえすと、「ライセニン耐性変異株を分離してみよう」と思うにいたる一連の出来事は、自然科学の神がさりげなく落とした大きなチャンスであったことがよくわかります。このチャンスをちゃんと拾えたのは、ルイス・パスツール(Louis Pasteur, 1822-1895年)がのたもうた「観察(研究)の世界では、幸運の女神は準備している者にしか微笑まない。”In the fields of observation, chance favors the prepared mind.”」ということなのですと少しく自慢しておきたいと思います。
余談2
2001年の暮れもおしつまった12月晦日近くに、数年間を費やしてやっと手にしたcDNA配列をDNA配列データベースにたいしてホモロジー検索にかけ、「Type 4 collagen ---, 4型コラーゲン云々」との回答がモニターに表示されたときには、「よりによってコラーゲンとは!クローニングは完全に失敗だ。LY-A株がセラミド輸送欠損株と主張していたこと自体も間違いだったのか?」と愕然となりました。もう夜遅いのでその日は悶々と帰宅し、翌日に悄然としてその論文を読んでみると、コラーゲンそのものではなく、コラーゲンに結合するキナーゼという報告内容だったので少し息を吹き返しました。内容的に首をかしげるような情報がところどころにあったので思いなおして(本文参照)、タンパク質の機能ドメインの類似性検索をおこなってみると--- 脂質転移に関連しそうなSTARTドメインをGPBPやGPBPΔ26はもっているではありませんか!
「これはセラミド輸送タンパク質そのものであるかもしれない!」と、おおいに勇気づけられて、先に進めたわけです。私たちの手で、大腸菌で発現させて精製した組換え体CERT/GPBPΔ26やGPBP/CERTLをしらべたかぎりでは、セラミド転移活性は観察されても、キナーゼ活性を認めることはまだできていません(未発表結果)。このような未発表の観察結果も含めますと、このタンパク質の本来の役割は細胞内のセラミド輸送であると明確に主張するには、CERTという新しい名前を与えることがやはり妥当であると思われます。
余談3
CERTという名称は、生理機能にちなんでつけたわけですが、命名にあたり、英語として短い一言で発音できることも念頭に入れていました。CERTなら、「本命馬」の意味をもつ普通名詞certとおなじく”サート”と一音節で言えます。改名を提示できずにGPBPΔ26のままにしておけば、ceramide transportという役目を類推できない名前のまま、ジー・ピー・ビー・ピー・デルタ・ツウェンティー・シクスという長い音節の名称を使い続けることになったでしょう。既存の科学用語を、新しい知見などを織り込みつつ、多くのひとにとって使い勝手のよい合理的なものになるように適切に改訂することは必要です。
引用文献
[1] van Meer G, Voelker DR, Feigenson GW (2008) Membrane lipids: where they are and how they behave, Nat Rev Mol Cell Biol, 9, 112-124.
[2] Soccio RE, Breslow JL (2004) Intracellular cholesterol transport, Arterioscler Thromb Vasc Biol, 24, 1150-1160.
[3] Raetz CR, Whitfield C (2002) Lipopolysaccharide endotoxins, Annu Rev Biochem, 71, 635-700.
[4] Okuda S, Freinkman E, Kahne D (2012) Cytoplasmic ATP hydrolysis powers transport of lipopolysaccharide across the periplasm in E. coli, Science, 338, 1214-1217.
[5] Hanada K (2003) Serine palmitoyltransferase, a key enzyme of sphingolipid metabolism, Biochim Biophys Acta, 1632, 16-30.
[6] Merrill AH, Jr. (2012) Sphingolipid and glycosphingolipid metabolic pathways in the era of sphingolipidomics, Chem Rev, 111, 6387-6422.
[7] Ardail D, Popa I, Bodennec J, Louisot P, Schmitt D, Portoukalian J (2003) The mitochondria-associated endoplasmic-reticulum subcompartment (MAM fraction) of rat liver contains highly active sphingolipid-specific glycosyltransferases, Biochem J, 371, 1013-1019.
[8] Kohyama-Koganeya A, Sasamura T, Oshima E, Suzuki E, Nishihara S, Ueda R, Hirabayashi Y (2004) Drosophila glucosylceramide synthase: a negative regulator of cell death mediated by proapoptotic factors, J Biol Chem, 279, 35995-36002.
[9] Sekizawa Y, Kubo T, Kobayashi H, Nakajima T, Natori S (1997) Molecular cloning of cDNA for lysenin, a novel protein in the earthworm Eisenia foetida that causes contraction of rat vascular smooth muscle, Gene, 191, 97-102.
[10] Yamaji A, Sekizawa Y, Emoto K, Sakuraba H, Inoue K, Kobayashi H, Umeda M (1998) Lysenin, a novel sphingomyelin-specific binding protein, J Biol Chem, 273, 5300-5306.
[11] Kobayashi H, Ohta N, Umeda M (2004) Biology of lysenin, a protein in the coelomic fluid of the earthworm Eisenia foetida, Int Rev Cytol, 236, 45-99.
[12] Kiyokawa E, Baba T, Otsuka N, Makino A, Ohno S, Kobayashi T (2005) Spatial and functional heterogeneity of sphingolipid-rich membrane domains, J Biol Chem, 280, 24072-24084.
[13] Hanada K, Hara T, Fukasawa M, Yamaji A, Umeda M, Nishijima M (1998) Mammalian cell mutants resistant to a sphingomyelin-directed cytolysin. Genetic and biochemical evidence for complex formation of the LCB1 protein with the LCB2 protein for serine palmitoyltransferase, J Biol Chem, 273, 33787-33794.
[14] Fukasawa M, Nishijima M, Hanada K (1999) Genetic evidence for ATP-dependent endoplasmic reticulum-to-Golgi apparatus trafficking of ceramide for sphingomyelin synthesis in Chinese hamster ovary cells, J Cell Biol, 144, 673-685.
[15] Pagano RE, Martin OC, Kang HC, Haugland RP (1991) A novel fluorescent ceramide analogue for studying membrane traffic in animal cells: accumulation at the Golgi apparatus results in altered spectral properties of the sphingolipid precursor, J Cell Biol, 113, 1267-1279.
[16] Funakoshi T, Yasuda S, Fukasawa M, Nishijima M, Hanada K (2000) Reconstitution of ATP- and cytosol-dependent transport of de novo synthesized ceramide to the site of sphingomyelin synthesis in semi-intact cells, J Biol Chem, 275, 29938-29945.
[17] Fukasawa M, Nishijima M, Itabe H, Takano T, Hanada K (2000) Reduction of sphingomyelin level without accumulation of ceramide in Chinese hamster ovary cells affects detergent-resistant membrane domains and enhances cellular cholesterol efflux to methyl-beta -cyclodextrin, J Biol Chem, 275, 34028-34034.
[18] Hanada K, Kumagai K, Yasuda S, Miura Y, Kawano M, Fukasawa M, Nishijima M (2003) Molecular machinery for non-vesicular trafficking of ceramide, Nature, 426, 803-809.
[19] Raya A, Revert F, Navarro S, Saus J (1999) Characterization of a novel type of serine/threonine kinase that specifically phosphorylates the human goodpasture antigen, J Biol Chem, 274, 12642-12649.
[20] Raya A, Revert-Ros F, Martinez-Martinez P, Navarro S, Rosello E, Vieites B, Granero F, Forteza J, Saus J (2000) Goodpasture antigen-binding protein, the kinase that phosphorylates the goodpasture antigen, is an alternatively spliced variant implicated in autoimmune pathogenesis, J Biol Chem, 275, 40392-40399.
[21] Kumagai K, Yasuda S, Okemoto K, Nishijima M, Kobayashi S, Hanada K (2005) CERT mediates intermembrane transfer of various molecular species of ceramides, J Biol Chem, 280, 6488-6495.
[22] Kawano M, Kumagai K, Nishijima M, Hanada K (2006) Efficient trafficking of ceramide from the endoplasmic reticulum to the Golgi apparatus requires a VAMP-associated protein-interacting FFAT motif of CERT, J Biol Chem, 281, 30279-30288.
[23] Balla T, Szentpetery Z, Kim YJ (2009) Phosphoinositide signaling: new tools and insights, Physiology (Bethesda), 24, 231-244.
[24] Sugiki T, Takeuchi K, Yamaji T, Takano T, Tokunaga Y, Kumagai K, Hanada K, Takahashi H, Shimada I (2012) Structural basis for the Golgi association by the pleckstrin homology domain of the ceramide trafficking protein (CERT), J Biol Chem, 287, 33706-33718.
[25] Ponting CP, Aravind L (1999) START: a lipid-binding domain in StAR, HD-ZIP and signalling proteins, Trends Biochem Sci, 24, 130-132.
[26] Kudo N, Kumagai K, Tomishige N, Yamaji T, Wakatsuki S, Nishijima M, Hanada K, Kato R (2008) Structural basis for specific lipid recognition by CERT responsible for nonvesicular trafficking of ceramide, Proc Natl Acad Sci U S A, 105, 488-493.
[27] Kudo N, Kumagai K, Matsubara R, Kobayashi S, Hanada K, Wakatsuki S, Kato R (2010) Crystal structures of the CERT START domain with inhibitors provide insights into the mechanism of ceramide transfer, J Mol Biol, 396, 245-251.
[28] Sugiki T, Takahashi H, Nagasu M, Hanada K, Shimada I (2010) Real-time assay method of lipid extraction activity, Anal Biochem, 399, 162-167.
[29] Loewen CJ, Roy A, Levine TP (2003) A conserved ER targeting motif in three families of lipid binding proteins and in Opi1p binds VAP, Embo J, 22, 2025-2035.
[30] Hanada K (2006) Discovery of the molecular machinery CERT for endoplasmic reticulum-to-Golgi trafficking of ceramide, Mol Cell Biochem, 286, 23-31.
[31] Hanada K, Kumagai K, Tomishige N, Kawano M (2007) CERT and intracellular trafficking of ceramide, Biochim Biophys Acta, 1771, 644-653.
[32] Hanada K, Kumagai K, Tomishige N, Yamaji T (2009) CERT-mediated trafficking of ceramide, Biochim Biophys Acta, 1791, 684-691.
[33] Hanada K (2010) Intracellular trafficking of ceramide by ceramide transfer protein, Proc Jpn Acad Ser B Phys Biol Sci, 86, 426-437.
[34] Friedman JR, Voeltz GK (2011) The ER in 3D: a multifunctional dynamic membrane network, Trends Cell Biol, 21, 709-717.
[35] Staehelin LA (1997) The plant ER: a dynamic organelle composed of a large number of discrete functional domains, Plant J, 11, 1151-1165.
[36] Mogelsvang S, Marsh BJ, Ladinsky MS, Howell KE (2004) Predicting function from structure: 3D structure studies of the mammalian Golgi complex, Traffic, 5, 338-345.
[37] Holthuis JC, Levine TP (2005) Lipid traffic: floppy drives and a superhighway, Nat Rev Mol Cell Biol, 6, 209-220.
[38] Elbaz Y, Schuldiner M (2011) Staying in touch: the molecular era of organelle contact sites, Trends Biochem Sci, 36, 616-623.
[39] Helle SC, Kanfer G, Kolar K, Lang A, Michel AH, Kornmann B (2013) Organization and Function of Membrane Contact Sites, Biochim Biophys Acta,
[40] Kumagai K, Kawano M, Shinkai-Ouchi F, Nishijima M, Hanada K (2007) Interorganelle trafficking of ceramide is regulated by phosphorylation-dependent cooperativity between the PH and START domains of CERT, J Biol Chem, 282, 17758-17766.
[41] Fugmann T, Hausser A, Schoffler P, Schmid S, Pfizenmaier K, Olayioye MA (2007) Regulation of secretory transport by protein kinase D-mediated phosphorylation of the ceramide transfer protein, J Cell Biol, 178, 15-22.
[42] Tomishige N, Kumagai K, Kusuda J, Nishijima M, Hanada K (2009) Casein kinase I{gamma}2 down-regulates trafficking of ceramide in the synthesis of sphingomyelin, Mol Biol Cell, 20, 348-357.
[43] Saito S, Matsui H, Kawano M, Kumagai K, Tomishige N, Hanada K, Echigo S, Tamura S, Kobayashi T (2008) Protein phosphatase 2Cepsilon is an endoplasmic reticulum integral membrane protein that dephosphorylates the ceramide transport protein CERT to enhance its association with organelle membranes, J Biol Chem, 283, 6584-6593.
[44] Swanton C, Marani M, Pardo O, Warne PH, Kelly G, Sahai E, Elustondo F, Chang J, Temple J, Ahmed AA, Brenton JD, Downward J, Nicke B (2007) Regulators of mitotic arrest and ceramide metabolism are determinants of sensitivity to paclitaxel and other chemotherapeutic drugs, Cancer Cell, 11, 498-512.
[45] Lee AJ, Roylance R, Sander J, Gorman P, Endesfelder D, Kschischo M, Jones NP, East P, Nicke B, Spassieva S, Obeid LM, Birkbak NJ, Szallasi Z, McKnight NC, Rowan AJ, Speirs V, Hanby AM, Downward J, Tooze SA, Swanton C (2012) CERT depletion predicts chemotherapy benefit and mediates cytotoxic and polyploid-specific cancer cell death through autophagy induction, J Pathol, 226, 482-494.
[46] Florin L, Pegel A, Becker E, Hausser A, Olayioye MA, Kaufmann H (2009) Heterologous expression of the lipid transfer protein CERT increases therapeutic protein productivity of mammalian cells, J Biotechnol, 141, 84-90.
[47] Olayioye MA, Hausser A (2012) Integration of non-vesicular and vesicular transport processes at the Golgi complex by the PKD-CERT network, Biochim Biophys Acta, 1821, 1096-1103.
[48] Elwell CA, Jiang S, Kim JH, Lee A, Wittmann T, Hanada K, Melancon P, Engel JN (2011) Chlamydia trachomatis co-opts GBF1 and CERT to acquire host sphingomyelin for distinct roles during intracellular development, PLoS Pathog, 7, e1002198.
[49] Derre I, Swiss R, Agaisse H (2011) The lipid transfer protein CERT interacts with the Chlamydia inclusion protein IncD and participates to ER-Chlamydia inclusion membrane contact sites, PLoS Pathog, 7, e1002092.
[50] Amako Y, Syed GH, Siddiqui A (2011) Protein kinase D negatively regulates hepatitis C virus secretion through phosphorylation of oxysterol-binding protein and ceramide transfer protein, J Biol Chem, 286, 11265-11274.
[51] van Ooij C, Kalman L, van I, Nishijima M, Hanada K, Mostov K, Engel JN (2000) Host cell-derived sphingolipids are required for the intracellular growth of Chlamydia trachomatis, Cell Microbiol, 2, 627-637.
[52] Perry RJ, Ridgway ND (2006) Oxysterol-binding protein and vesicle-associated membrane protein-associated protein are required for sterol-dependent activation of the ceramide transport protein, Mol Biol Cell, 17, 2604-2616.
[53] Rao RP, Yuan C, Allegood JC, Rawat SS, Edwards MB, Wang X, Merrill AH, Jr., Acharya U, Acharya JK (2007) Ceramide transfer protein function is essential for normal oxidative stress response and lifespan, Proc Natl Acad Sci U S A, 104, 11364-11369.
[54] Wang X, Rao RP, Kosakowska-Cholody T, Masood MA, Southon E, Zhang H, Berthet C, Nagashim K, Veenstra TK, Tessarollo L, Acharya U, Acharya JK (2009) Mitochondrial degeneration and not apoptosis is the primary cause of embryonic lethality in ceramide transfer protein mutant mice, J Cell Biol, 184, 143-158.
[55] Halter D, Neumann S, van Dijk SM, Wolthoorn J, de Maziere AM, Vieira OV, Mattjus P, Klumperman J, van Meer G, Sprong H (2007) Pre- and post-Golgi translocation of glucosylceramide in glycosphingolipid synthesis, J Cell Biol, 179, 101-115.
[56] D'Angelo G, Polishchuk E, Di Tullio G, Santoro M, Di Campli A, Godi A, West G, Bielawski J, Chuang CC, van der Spoel AC, Platt FM, Hannun YA, Polishchuk R, Mattjus P, De Matteis MA (2007) Glycosphingolipid synthesis requires FAPP2 transfer of glucosylceramide, Nature, 449, 62-67.
[57] Mencarelli C, Losen M, Hammels C, De Vry J, Hesselink MK, Steinbusch HW, De Baets MH, Martinez-Martinez P (2010) The ceramide transporter and the Goodpasture antigen binding protein: one protein--one function?, J Neurochem, 113, 1369-1386.
[58] Revert F, Ventura I, Martinez-Martinez P, Granero-Molto F, Revert-Ros F, Macias J, Saus J (2008) Goodpasture antigen-binding protein is a soluble exportable protein that interacts with type IV collagen. Identification of novel membrane-bound isoforms, J Biol Chem, 283, 30246-30255.
[59] Granero-Molto F, Sarmah S, O'Rear L, Spagnoli A, Abrahamson D, Saus J, Hudson BG, Knapik EW (2008) Goodpasture antigen-binding protein and its spliced variant, ceramide transfer protein, have different functions in the modulation of apoptosis during zebrafish development, J Biol Chem, 283, 20495-20504.
[60] Mencarelli C, Bode GH, Losen M, Kulharia M, Molenaar PC, Veerhuis R, Steinbusch HW, De Baets MH, Nicolaes GA, Martinez-Martinez P (2012) Goodpasture antigen-binding protein/ceramide transporter binds to human serum amyloid P-component and is present in brain amyloid plaques, J Biol Chem, 287, 14897-14911.
[61] Olsen JV, Blagoev B, Gnad F, Macek B, Kumar C, Mortensen P, Mann M (2006). Global, in vivo, and site-specific phosphorylation dynamics in signaling networks. Cell 127, 635-648.
[62] Kumagai K, Kawano-Kawada M, Hanada K (2014) Phosphoregulation of CERT at serine 315 in the interaction with VAMP-associated protein (VAP) for inter-organelle trafficking of ceramide in mammalian cells, J Biol Chem, 289, 10748-10760.
[63] Yamaji T, Hanada K (2014) Establishment of HeLa cell mutants deficient in sphingolipid-related genes by using TALENs, PLoS ONE, 9, e88124.
花田賢太郎(感染研 品質保証・管理部、細胞化学部併任)
(2013年2月18日)(2014年7月22日 9-4節、10節一部の追加改訂2016年9月13日 一部修文、 2017年9月29日一部修文)
(2018年11月19日 図2:Dihydroceramide desaturase反応改訂)(2021年4月1日 所属更新)
関連する他のページ一覧
III. 哺乳動物細胞におけるセラミド輸送に関する研究(このページ)
V. Vero細胞の物語 ~その樹立からゲノム構造の決定、そして未来へ~
その他の記事
2. スフィンゴ脂質およびセラミドの命名事始め(外部サイトへリンク)
3. セラミド研究史概略(外部サイトへリンク)