(IDWR 2002年第17号掲載)
緑膿菌における多剤耐性獲得の歴史と変遷
多剤耐性緑膿菌(multiple‐drug‐resistant Pseudomonas aeruginosa)という用語は、既に1970 年代に論文等に登場している1)が、 当時は、緑膿菌に有効であった、ゲンタマイシン、カナマイシン などを含む複数の抗菌薬に対しR‐プラスミド依存性に耐性を獲得した株を漠然と指していた。1980 年代後半になると、緑膿菌を含むグラム陰性桿菌に広く効果が期待できるフルオロキノロン(=ニューキノロン)、広域β‐ラクタム、アミノ配糖体などに耐性 を獲得した株に対しこの語が当てられるようになった 2)。
最近では、緑膿菌に対し強い抗菌感活性が期待できるシプロフロキサシンやレボフロキサシン などのフルオロキノロンやイミペネムなどのカルバペネム、アミカシンなどの抗緑膿菌用アミノ配糖 体の三系統の抗菌薬に耐性を獲得した株を「多剤耐性緑膿菌」とする場合が多いようである。
緑膿菌における薬剤耐性の獲得状況
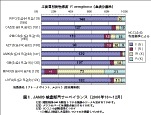
「院内感染対策サーベイランス事業(JANIS)」の結果によれば、フルオロキノロンやカルバペネ ムに感受性を喪失(S以外と判定)した株の国内での分離状況は、2000年の血液分離株の場合、 各々20%程度に達しており、さらにアミカシンなどのアミノ配糖体に感受性を喪失(S以外)したと判 定される株は5%前後に及んでいる 3), 4)。
米国CDCの「Division of Healthcare Quality Promotion(旧Hospital Infections Program)」でも、1989 年頃よりカルバペネムやフルオロキノロン耐性を獲得した緑膿菌の動向が監視されており、最近 のIntensive Care Antimicrobial Resistance Epidemiology(ICARE)の報告では、イミペネム耐性株は、 1997年時点で15%弱、オフロキサシンあるいはシプロフロキサシン耐性株は16%程度に達してい る 5)。また、米国内の別の調査(The Surveillance Net work Database USA)でも、2000年にはイミペ ネム耐性株は15%弱と横這い傾向であるが、シプロフロキサシン耐性株は30%弱に達しておりそ の動向が警戒されている 6)。
「多剤耐性緑膿菌」の現状
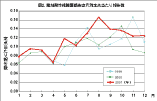
感染症法では、フルオロキノロン、カルバペネム、アミノ配糖体の三系統の抗菌薬に耐性を獲 得した、新型「多剤耐性緑膿菌」を「薬剤耐性緑膿菌」感染症として4類の定点把握疾患に指定している(註:2003年11月施行の感染症法一部改正によ り、5類感染症定点把握疾患に変更)。その理由は、従来より各種の抗菌薬に耐性を示す傾向が強い緑膿菌において、最後 の「切り札」的な存在であるこの三系統の抗菌薬に耐性を獲得した「多剤耐性株」の出現は、医 療にとって大きな障害となる事が懸念されたためである。現在、そのような株の分離率は、国内では1〜数%程度と推定されているが、施設によりその状況は大 きく異なっており、詳細は不明であ る。感染症法に基づく2001年の「薬剤耐性緑膿菌感染症」の報告件数は、1定点施設で月あたり約0.1件で、MRSA感染症やVRE感染症に比べ低い値 となっているが、年間の報告総件数は618件に達し、毎月平均50件前後が恒常的に報告されている。カルバペネムなどに耐性を獲得し た緑膿菌は、血液疾患や悪性腫瘍の手術後、骨髄移植を含む臓器移植後などの患者さんから 分離される事例も多い 7)。 したがって、敗血症や腹膜炎などを起こした場合、化学療法に抵抗し 治療に難渋する事が懸念されており、患者の予後や死亡率を悪化させる主要な要因の一つとし て警戒されている。事実、最近、新潟県や神奈川県の病院での感染死亡事例が報道されており、 一般にも「多剤耐性緑膿菌」について関心が高まりつつある。
緑膿菌における多剤耐性獲得の分子機構
緑膿菌が多剤耐性を獲得する機構として、以下の7つの機構が挙げられる。
1)内因性の耐性機構
特定の抗菌薬を使い続ける事により、細菌が本来持っている内在性の遺伝子が変化し、耐性を獲得する例を以下に示す。
1. DNAジャイレース、トポイソメラーゼなどの標的蛋白の変異(フルオロキノロン耐性)
2. D2ポリンの減少など細菌外膜の変化(イミペネム耐性)
3. 薬剤能動排出ポンプの機能亢進(フルオロキノロン耐性、その他の薬剤耐性、消毒薬抵抗性)
4. AmpC型β‐ラクタマーゼなど分解酵素の過剰産生(広域セファロスポリン耐性)
5. 細胞表層多糖体であるアルギン酸莢膜多糖などを主成分とするバイオフィルムの産生の増加
2)獲得性の耐性機構
細菌が、他の耐性菌株から伝達性のR‐プラスミドを介して耐性遺伝子を外来性に新たに獲得する事により耐性化する例を以下に示す。
1. IMP‐型メタロ‐β‐ラクタマーゼの産生(広域セフェム耐性、カルバペネム耐性)
2. アミノグリコシドアセチル化酵素などの薬剤修飾不活化酵素の産生(アミカシン等アミノ配糖 体耐性など)
これまで我が国では、緑膿菌などのグラム陰性桿菌感染症に対してはイミペネムなどのカルバ ペネム薬が使用されて来たが、細胞外膜のD2ポリンの減少によると思われるイミペネム耐性株 (IPMのMIC値が32μg/ml程度まで)は、前述した如く既に2割前後に達している。それに加えさら に、特にプラスミド依存性にIMP‐型やVIM‐型メタロ‐β‐ラクタマーゼの産生能力を獲得した一部の株においては、IPMなどのMIC値が維持可能な 血中濃度をはるかに上回る128μg/mlを超える ものがあり 8)、最近、海外でも院内感染の原因となる耐性菌としてその動向が警戒されつつある 9),10)。
多剤耐性緑膿菌の監視と対策
このような事態を背景に、1999年4月より施行された「感染症法」では、4類疾患感染症の病原 体の中に、前述の三系統の抗菌薬に広範な耐性を獲得した株を「薬剤耐性緑膿菌」として指定し、その動向を把握するため、定点施設で感染症例が発生した場合 には報告を求めている(註:2003年11月施行の感染症法一部改正により、5類感染症定点把握疾患に変更)。毎月平均50件前後が恒常的に報告されてお り、臨床現場で無視できない状況となっている事が示 唆される。一方、平成12年度より開始された厚生労働省「院内感染対策サーベイランス事業 (JANIS)」では、臨床分離緑膿菌における薬剤耐性の獲得状況やそれによる感染症の実態や動 向が把握されようとしている。
|
図1. JANIS 検査部門サーベイランス(2000 年10 〜12 月) |
図2. 薬剤耐性緑膿菌感染症月別定点当たり報告数 |
さいごに
既にグラム陽性球菌である黄色ブドウ球菌、腸球菌、肺炎球菌から各々、MRSA、VRE、PRSP などが出現し、世界的に蔓延しつつあり大きな問題となっている。そのような中で、今後、緑膿菌 やアシネトバクターなどのブドウ糖非発酵菌のみならず、セラチアやエンテロバクター、シトロバク ター、肺炎桿菌、大腸菌などの腸内細菌科に属するグラム陰性桿菌における多剤耐性化の進行 が現実的な驚異となっている。そのため、この種の多剤耐性株の動向について、各医療施設で 十分に監視を行うとともに、それらを増加させないための監視や抗菌薬の使用方法について、よ り一層の配慮や注意が必要となっている。
感染症法における取り扱い(2012年7月更新)
「薬剤耐性緑膿菌感染症」は定点報告対象(5類感染症)であり、指定届出機関(全国約500カ所の基幹定点医療機関)は月毎に保健所に届け出なければならない。
届出基準はこちら
【参考文献】
1)Suzuki S, Miyoshi Y, Nakaya R, 1978, R plasmids among Gram‐negative bacteria with multiple drug resistance isolated in a general hospital, Microbiol. Immunol. 22 :235‐247.
2)Sanders CC, Sanders WE Jr, Goering RV, and Werner V, 1984, Selection of multiple antibiotic resistance by quinolones, beta‐lactams, and aminoglycosides with special reference to cross‐resistance between unrelated drug classes, Antimicrob. Agents Chemother.26 :797‐ 801.
3) 院内感染対策サーベイランス(JANIS)<http://www.nih-janis.jp/>
4) Kurokawa H, Yagi T, Shibata N, Shibayama K, and Arakawa Y,1999, Lancet 354 (9182 ):955.
5) Fridkin SK, and Gaynes RP.1999, Antimicrobial resistance in intensive care units. Clin. Chest. Med.20:303‐ 16
6 ) Livermore DM, Multiple mechanisms of antimicrobial resistance in Pseudomonas aeruginosa:our worst nightmare? Clin Infect Dis.2002 Mar 1 ;34 (5 ):634‐40.
7) Hirakata Y, Izumikawa K, Yamaguchi T, Takemura H, Tanaka H, Yoshida R, Matsuda J, Nakano M, Tomono K, Maesaki S, Kaku M, Yamada Y, Kamihira S, and Kohno S, 1998, Rapid detection and evaluation of clinical characteristics of emerging multiple‐drug‐resistant gram‐negative rods carrying the metallo‐beta‐lactamase gene blaIMP. Antimicrob. Agents Chemother. 42 :2006‐2011.
8) Senda K, Arakawa Y, Nakashima K, Ito H, Ichiyama S, Shimokata K, Kato N, and Ohta M, 1996, Multifocal outbreaks of metallo‐beta‐lactamase‐producing Pseudomonas aeruginosa resistant to broad‐spectrum beta‐lactams, including carbapenems, Antimicrob. Agents Chemother. 40:349‐353.
9) Gibb AP, Tribuddharat C, Moore RA, Louie TJ, Krulicki W, Livermore DM, Palepou MF, and Woodford N, 2002, Nosocomial outbreak of carbapenem‐resistant Pseudomonas aeruginosa with a new bla(IMP)allele, bla (IMP‐7), Antimicrob.Agents Chemother. 46:255‐ 258.
10) Cornaglia G, Mazzariol A, Lauretti L, Rossolini GM, Fontana R, 2000, Hospital outbreak of carbapenem‐resistant Pseudomonas aeruginosa producing VIM‐1, a novel transferable metallo‐beta‐lactamase, Clin.Infect. Dis.31 :1119‐1125.
(国立感染症研究所細菌第二部 荒川宜親)