お知らせ
感染症情報
研究・検査・病原体管理
サーベイランス
刊行・マニュアル・基準
感染症検体パネル
感染症検体パネル
- 詳細
感染症検体パネルについて
国立感染症研究所(感染研)では薬食機発0304第1号の通知(下記リンクよりダウンロードできます)に基づき、平成25年4月1日より公衆衛生上特に重要な感染症の検体を集めた血清・血漿パネル(感染症検体パネル)の申請受け付けを開始しました。これらの感染症検体パネルは、薬食機発0304第1号に示されているように体外診断用医薬品の製造販売承認申請時の添付資料のうち、既存体外診断用医薬品との相関性に関する資料の作成に利用できます。
現在、配付が可能な感染症検体パネルは下記の10種類です。
・A型肝炎ウイルス(IgG抗体)陽性検体パネル
・A型肝炎ウイルス(IgG抗体)陰性検体パネル
・B型肝炎ウイルス(HBs抗原、HBV-DNA)陽性検体パネル
・B型肝炎ウイルス(HBs抗原、HBV-DNA)陰性検体パネル
・C型肝炎ウイルス(コア抗原、抗体、HCV-RNA)陽性検体パネル
・C型肝炎ウイルス(コア抗原、抗体、HCV-RNA)陰性検体パネル
・ヒト免疫不全ウイルス1型(抗原、抗体、HIV-1-RNA)陽性検体パネル
・ヒト免疫不全ウイルス1型(抗原、抗体、HIV-1-RNA)陰性検体パネル
・ヒトT細胞白血病ウイルス1型(抗体)陽性検体パネル
・ヒトT細胞白血病ウイルス1型(抗体)陰性検体パネル
・風疹ウイルス(IgG抗体)陽性検体パネル
・風疹ウイルス(IgG抗体)陰性検体パネル
これらの感染症検体パネルは「国立感染症研究所国内標準パネル運営委員会」により譲渡の可否を審査された後に譲渡されます。
申請にあたり、
1) 申請には感染症検体パネル譲渡申請書(様式1)を使用してください。陽性・陰性両方の検体パネルが必要な場合には、それぞれの譲渡申請書を作成してください。
2) 申請品および相関性試験に使用する対照品、各々1回測定分を譲渡いたします。「分量」の項目には、それぞれの測定に必要な量にデッドボリュームを加えた量とその合計量を記入してください。
3) 感染性物質を含む検体パネル(A型肝炎ウイルス陽性検体パネル、B型肝炎ウイルス陽性検体パネル、C型肝炎ウイルス陽性検体パネル、ヒト免疫不全ウイルス1型陽性検体パネル、ヒトT細胞白血病ウイルス1型(抗体)陽性検体パネル)の譲渡はバイオセーフティレベル2(BSL2)の実験室を有していることが条件になります。BSL2実験室確認書の提出をお願いします。
4) 感染性物質を含まない検体パネル(各種陰性検体パネル、風疹ウイルス陽性検体パネル)の申請にはBSL2実験室確認書は必要ありません。
5) 風疹ウイルス陰性パネル以外の感染症検体パネルでは50本以上からなる検体パネルの提供が可能です。
6) 感染症検体パネルは81本立紙箱(134mm x 134mm x 52 mm)もしくは50本立紙箱(76×148×52mm)で提供されます。譲渡される検体量に合わせて必要な梱包資材をご準備ください。譲渡される感染症検体パネルのロットについては、特別な理由がない限り指定できません。ロット指定が必要な場合はその理由を譲渡申請書に記載してください。
7) 陽性検体パネル引き渡しの際には、WHO の「感染性物質の輸送規則に関するガイダンス」に沿って包装基準 P650 に準拠した包装容器(UN3373)と、これを梱包するための保冷用オーバーパック、ドライアイスが必要になります。検体パネルの種類や譲渡数により必要な容器の大きさが異なります。
8) 梱包資材の準備が難しい場合、ドライアイスと保冷用オーバーパックのみをご準備いただき、それ以外の梱包資材についてはこちらで用意したものを使用していただくことが可能です。また検体譲渡を郵送(ゆうパック)で行うことも可能です。再利用できない消耗品については譲渡終了後に購入してご返送いただきます。
詳しくは当研究所業務管理課検定係にお尋ねください。
【問い合せ先】
国立感染症研究所総務部業務管理課検定係
〒208-0011 東京都武蔵村山市学園4-7-1
TEL:042-561-0771(代表)
FAX:042-565-3315
感染症検体パネルを用いた体外診断薬の性能評価結果
感染研では整備された感染症検体パネルを用いて、それらの病原体が関わる体外診断薬の性能評価を行なっており、その結果を学会や学術論文等で公表しています。得られた体外診断薬の性能および診断薬間の相関性のデータは、臨床でのこれら体外診断薬の使用において重要な情報であると考えられますので、ここに発表データの一部を掲載させていただきます。なお、この性能評価についてはAMED 医薬品等規制調和・評価研究事業「病原体検出に係る体外診断用医薬品の開発、評価、品質管理に関する研究」(研究代表者:浜口功)および一般社団法人 日本臨床検査薬協会 技術委員会との共同研究として行われています。
・ヒト免疫不全ウイルス1型検体パネルを用いた性能評価(2021年)
C型肝炎ウイルス検体パネルを用いた性能評価(2018年)
- 詳細
C型肝炎ウイルス検体パネルを用いた性能評価
(2018年)
A. 使用検体パネル
• HCV陽性検体パネル (2015);73検体
• HCV陰性検体パネル (2015);53検体
B. 評価キット
• HCV抗体キット;10キット
• HCVコア蛋白質キット;3キット
• HCV核酸キット;2キット
C. 評価結果
(1) 各キットによるパネル検体の検出率
HCV抗体キット
|
陽性検体パネル (N=73) |
陰性検体パネル (N=53) |
|
| HCV・アボット | 73 (100%) | 53 (100%) |
| オーソHCV Ab PAテストII | 73 (100%) | 53 (100%) |
| エクルーシス試薬Anti-HCVII | 73 (100%) | 53 (100%) |
| BLEIA‘栄研’HCV抗体 | 73 (100%) | 53 (100%) |
| ルミパルスプレスト HCV | 73 (100%) | 53 (100%) |
| ルミパルスプレスト オーソHCV | 73 (100%) | 53 (100%) |
| ルミパルスII オーソHCV | 73 (100%) | 53 (100%) |
| ビトロス HCV抗体 | 73 (100%) | 52 (98.1%) |
| オーソ HCV Ab LPIA L800N | 73 (100%) | 53 (100%) |
| オーソ クイックチェイサー HCV Ab | 73 (100%) | 53 (100%) |
HCVコア蛋白質キット
|
陽性検体パネル (N=73) |
陰性検体パネル (N=53) |
|
| HCV Ag・アボット | 67 (91.8%) | 53 (100%) |
| BLEIA‘栄研’HCV抗原 | 71 (97.3%) | 53 (100%) |
| ルミパルス オーソHCV抗原 | 63 (86.3%) | 53 (100%) |
HCV核酸キット
|
陽性検体パネル (N=73) |
陰性検体パネル (N=53) |
|
| アキュジーン m-HCV | 73 (100%) | 53 (100%) |
| コバスTaqMan HCV「オート」v2.0 | 73 (100%) | 53 (100%) |
(2) HCV核酸キットの相関
y = 0.9395x + 0.4726 (R2 = 0.9793)

(3) HCVコア蛋白質キットの相関
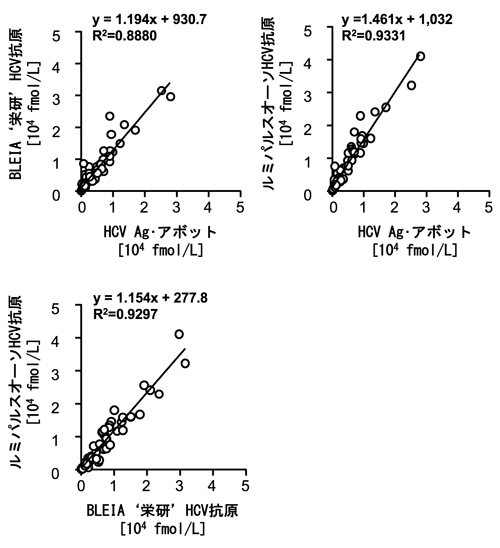
(4) HCV核酸キットとHCVコア蛋白質キットの相関
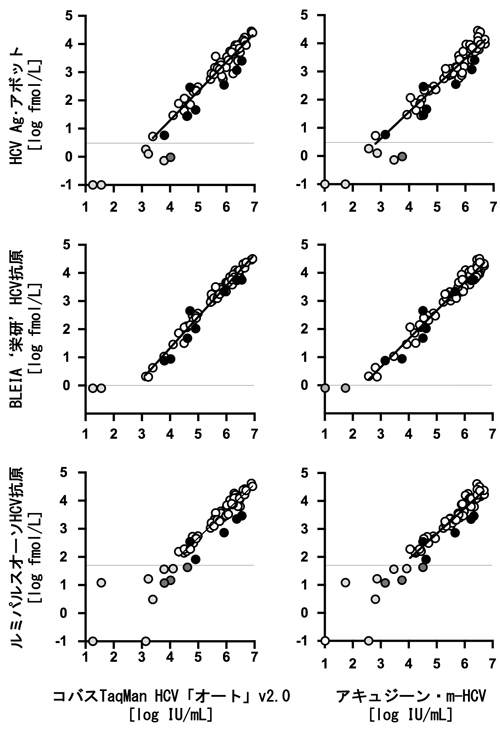
| 各キット間の相関 |
アキュジーン・ m-HCV (log IU/mL) |
コバスTaqMan HCV 「オート」v2.0 (log IU/mL)
|
|
HCV Ag・アボット (log fmol/L) |
y = 1.030x–2.825 R2 = 0.9052 |
y = 0.9482x–2.226 R2 = 0.9045 |
|
BLEIA‘栄研’ HCV抗原 (log fmol/L) |
y = 1.109x–3.104 R2 = 0.9723 |
y = 1.007x–2.381 R2 = 0.9607 |
|
ルミパルス オーソHCV抗原 (log fmol/L) |
y = 0.9551x–2.099 R2 = 0.9016 |
y = 0.9086x–1.714 R2 = 0.8987 |
(5) 本検討で使用したHCV検体パネルについて
本検討で使用したHCV検体パネルは「献血血液等の研究開発等への使用に関する指針」に基づく公募により日本赤十字社から譲渡された献血血液を用いて作製されています。
また、使用したHCV陽性検体パネルのHCVゲノムの配列は以下のAccession No.で公開されています。
・LC374814 - LC374886 (73 entries)
D. 発表論文
Evaluation of in vitro screening and diagnostic kits for hepatitis C virus infection.
Momose H, Matsuoka S, Murayama A, Yamada N, Okuma K, Ikebe E, Hoshi Y, Muramatsu M, Wakita T, Toyota K, Kato T, Hamaguchi I.
J Clin Virol. 2018 Jun 11; 105:97-102. doi: 10.1016/j.jcv.2018.06.008.
PMID: 29940422
E. 利益相反について
上記論文の著者らは本研究について開示すべき事項はありません。
本論文の内容のホームページへの掲載はエルゼビア社の許諾を得ています。
ヒト免疫不全ウイルス1型陽性/陰性検体パネルを用いた体外診断薬の性能評価
- 詳細
ヒト免疫不全ウイルス1型陽性/陰性検体パネルを用いた体外診断薬の性能評価
Evaluation of human immunodeficiency virus (HIV) in-vitro diagnostics using HIV-1 positive/negative reference panel
(2021年)
A. 使用検体
• HIV-1陽性検体:89検体(うち80検体がHIV-1陽性検体パネル2019ロットに含まれる)
• HIV-1陰性検体:106検体(うち80検体がHIV-1陰性検体パネル2019ロットに含まれる)
# これらの検体は「献血血液の研究開発等への使用に関する指針」に基づく公募により、日本赤十字社から2013〜2015年に譲渡を受けた献血血液を用いて作製された。
B. 使用体外診断薬
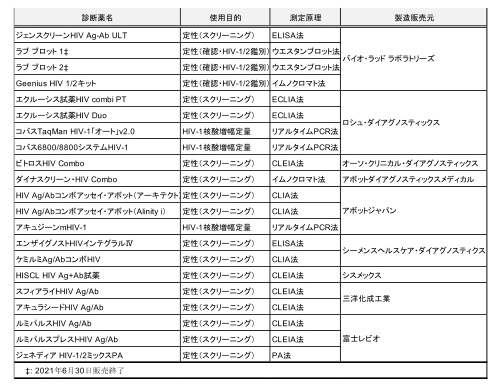

C. 評価結果
1. HIVスクリーニング検査試薬
a. イムノクロマト法

b. PA法
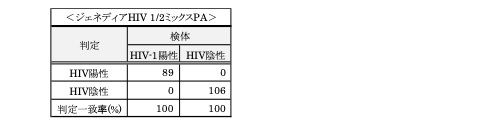
c. ELISA法
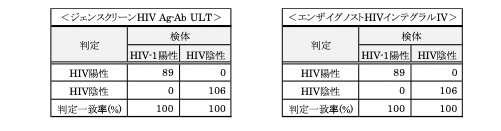
d. ECLIA法、CLEIA法、CLIA法
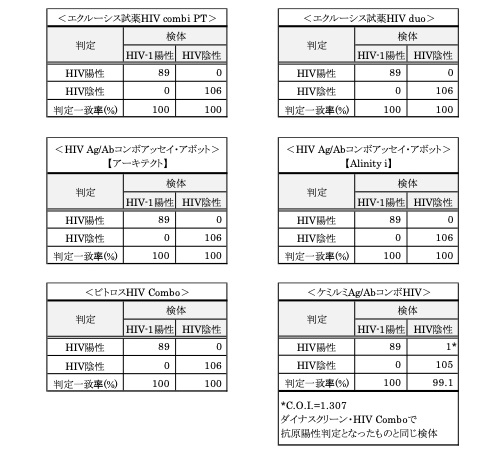
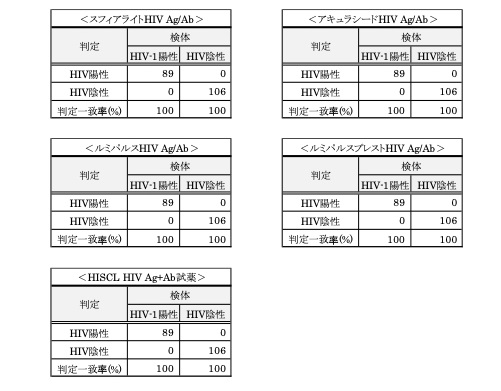
2. HIV-1/2抗体確認試薬
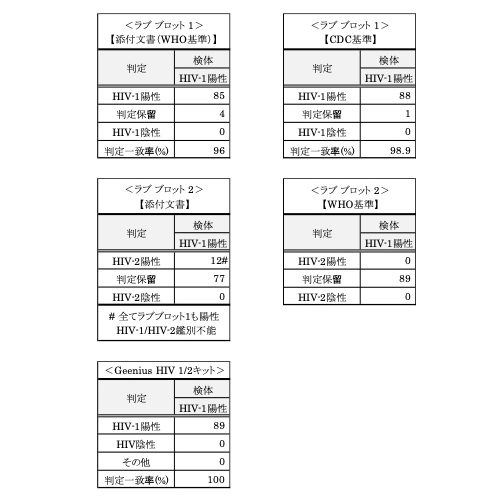
3. HIV-1核酸増幅定量試薬
a. シグナル検出の感度・特異度

注. これらの診断薬は定量試薬であり、抗体検出の確認検査用診断薬(ラブ ブロット1/2、Geenius HIV 1/2キット)の結果をもって確定診断を行うこと。感染診断の補助に用いる場合には、各施設においてデータ取り扱いの基準を定めて使用すること。(参考:診療におけるHIV-1/2感染症の診断ガイドライン2020版(日本エイズ学会・ 日本臨床検査医学会 標準推奨法))
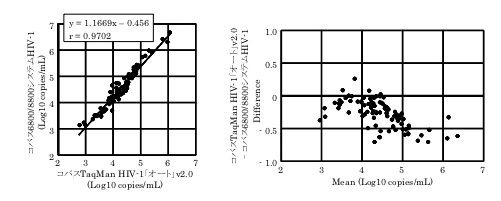
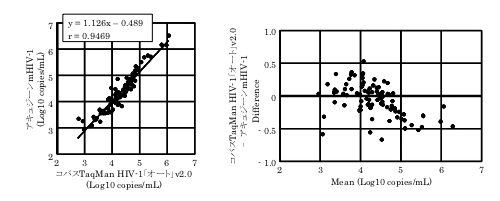
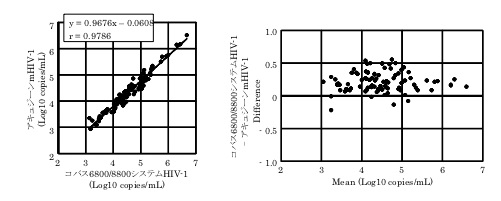
b. 測定値の相関(回帰直線式、Bland-Altman分析)
<コバスTaqMan HIV-1「オート」v2.0とコバス6800/8800システムHIV-1>
<コバスTaqMan HIV-1「オート」v2.0とアキュジーンmHIV-1>
<コバス6800/8800システムHIV-1とアキュジーンmHIV-1>
D. 発表論文
草川茂:HIV検出ウエスタンブロット診断薬の評価とわが国におけるHIV検査における使用法の検討. 感染症学雑誌 2019;93(1):12-17.
※ 本論文の内容のホームページへの掲載は一般社団法人日本感染症学会の許諾を得ています。
Kusagawa S., Kawana-Tachikawa A., Matsubayashi K., Hoshi Y., Ishimaru K., and Hamaguchi I. Evaluation of Geenius HIV-1/2 Confirmatory Assay for the confirmatory and differential diagnosis of HIV-1/HIV-2 in Japan and reliability of the Geenius Reader in the diagnosis of HIV-2. BMC Infect Dis. 2021 Jun 14;21(1):569. doi: 10.1186/s12879-021-06291-5. PMID: 34126953
※ 本論文のデータの一部を日本語に翻訳し掲載しました。本論文はCreative Commons Attribution License, CC-BY 4.0のもとに発表されCreative Commons CC0 1.0 Public Domain Dedication waiverの下で配信されました。
E. 利益相反について
本研究について、開示すべきCOI関係にある企業等はありません。
F. 研究倫理について
HIV-1陽性・陰性検体パネルの体外診断薬性能評価研究への使用については、国立感染症研究所ヒトを対象とする医学研究倫理審査の承認を得ています(受付番号1082)。
G. 本研究成果の二次利用・引用に関して
本掲載情報の著作権は国立感染症研究所に帰属します。
本研究成果の二次利用・引用は営利を目的としない場合のみといたします。無断の複製・転載は禁じられています。原資料を二次利用する場合には、国立感染症研究所事務局(総務部調整課)を通じ「国立感染症研究所・国内標準パネル運営委員会」にお問い合わせください。研究発表等でデータを引用する場合には、必ず国立感染症研究所・国内標準パネル運営委員会 (The committee for the preparation of reference panels of infectious disease specimens at the National Institute of Infectious Diseases, Japan) ホームページより引用したものであることを明記し、URLを表記してください。
B型肝炎ウイルス検体パネルを用いた性能評価(2019年)
- 詳細
B型肝炎ウイルス検体パネルを用いた性能評価
(2019年)
A. 使用検体パネル
• HBV陽性検体パネル (2015);80検体
• HBV陰性検体パネル (2015);53検体
B. 評価キット
• HBV DNA定量キット;2キット
• HBsAg検出キット;5キット
• HBsAg定量キット;7キット
• HBsAgイムノクロマトキット;3キット
C. 評価結果
(1) 各キットによる検体パネルの検出率
HBV DNA定量キット
|
陽性検体パネル (N=80) |
陰性検体パネル (N=53) |
|
| アキュジーン m-HBV | 78 (97.5%) | 53 (100%) |
| コバスTaqMan HBV「オート」v2.0 | 77 (96.3%) | 53 (100%) |
HBsAg検出キット
|
陽性検体パネル (N=80) |
陰性検体パネル (N=53) |
|
| ケミルミ HBs抗原 II | 80 (100%) | 53 (100%) |
| エクルーシス試薬 HBsAg II | 80 (100%) | 53 (100%) |
| エンザイグノスト HBsAg 6.0 | 80 (100%) | 53 (100%) |
| ステイシアCLEIA HBs抗原 | 77 (96.3%) | 53 (100%) |
| ビトロス HBs抗原 ES | 78 (97.5%) | 53 (100%) |
HBsAg定量キット
|
陽性検体パネル (N=73) |
陰性検体パネル (N=53) |
|
| アーキテクト・HBsAg QT | 80 (100%) | 53 (100%) |
| アキュラシード HBs抗原 | 79 (98.8%) | 53 (100%) |
| BLEIA 栄研 HBs抗原 | 80 (100%) | 53 (100%) |
| エクルーシス試薬 HBsAgⅡ quantⅡ | 80 (100%) | 53 (100%) |
| Eテスト「TOSOH」Ⅱ(HBsAg) | 77 (96.3%) | 53 (100%) |
| HISCL HBsAg 試薬 | 80 (100%) | 53 (100%) |
| ルミパルスプレスト HBsAg-HQ | 80 (100%) | 53 (100%) |
HBsAgイムノクロマトキット
|
陽性検体パネル (N=80) |
陰性検体パネル (N=53) |
|
| エスプライン HBsAg | 71 (88.8%) | 53 (100%) |
| ダイナスクリーン・HBsAg II | 71 (88.8%) | 53 (100%) |
| ダイナスクリーン HBsAg 2 Plus | 80 (100%) | 53 (100%) |
(2) HBV DNA定量キットの相関

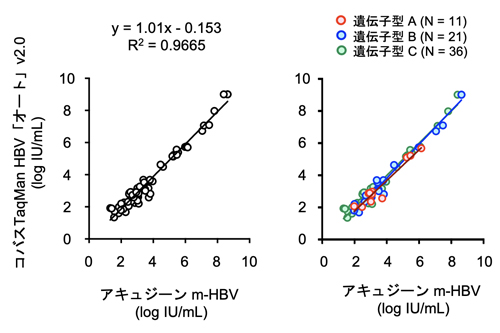
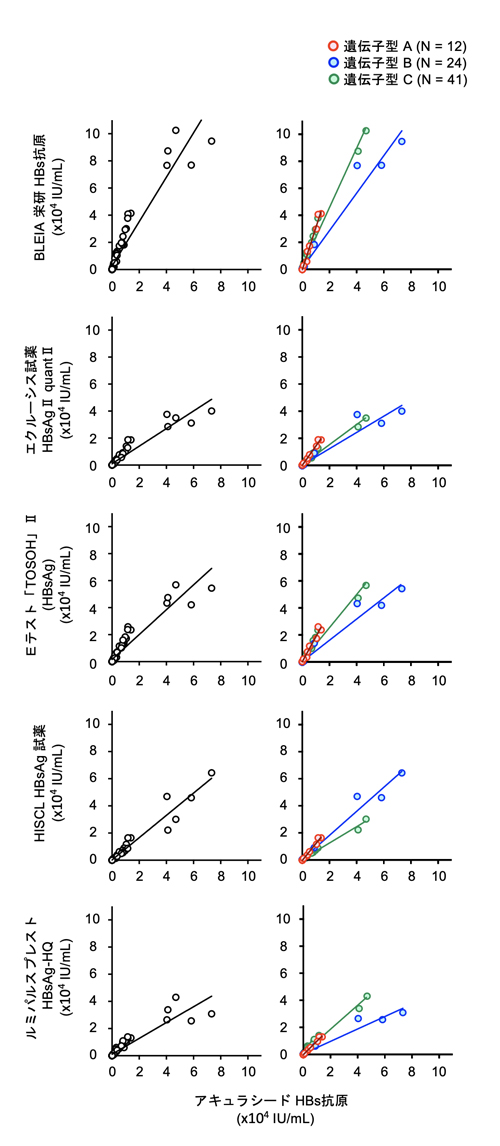
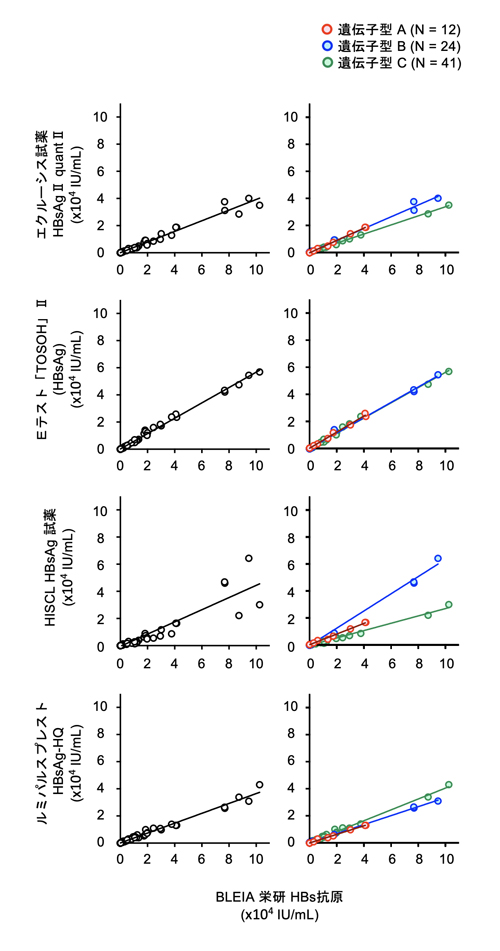
(3) HBsAg定量キットの相関
[アーキテクト・HBsAg QTとの相関 1]
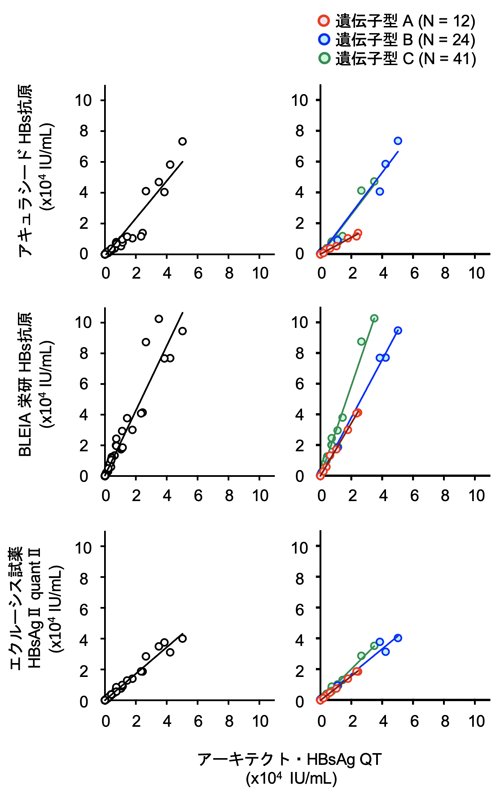
[アーキテクト・HBsAg QTとの相関 2]
[アキュラシード HBs抗原との相関]
[BLEIA 栄研 HBs抗原との相関]
[エクルーシス試薬 HBsAgⅡ quantⅡとの相関]
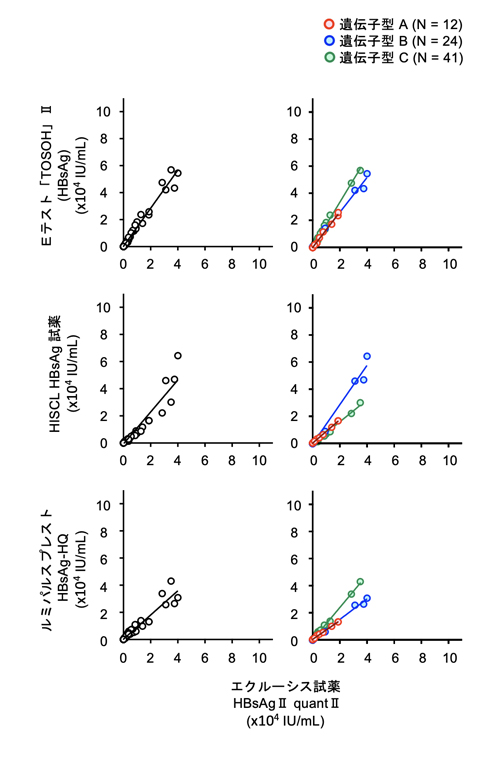
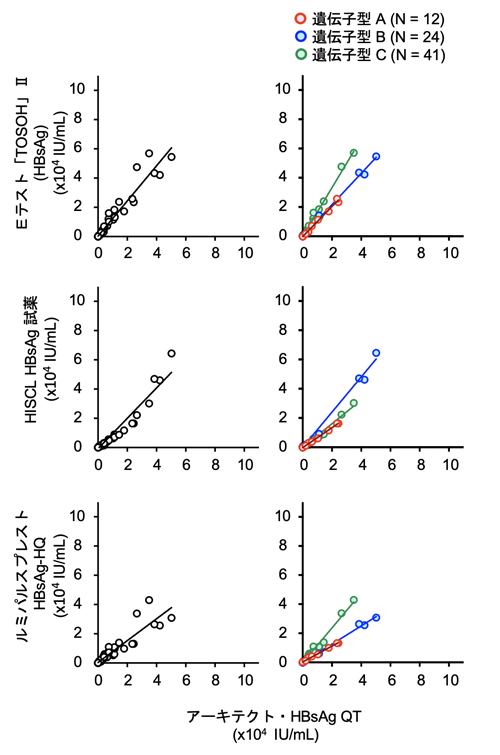
[Eテスト「TOSOH」Ⅱ(HBsAg), HISCL HBsAg 試薬との相関]
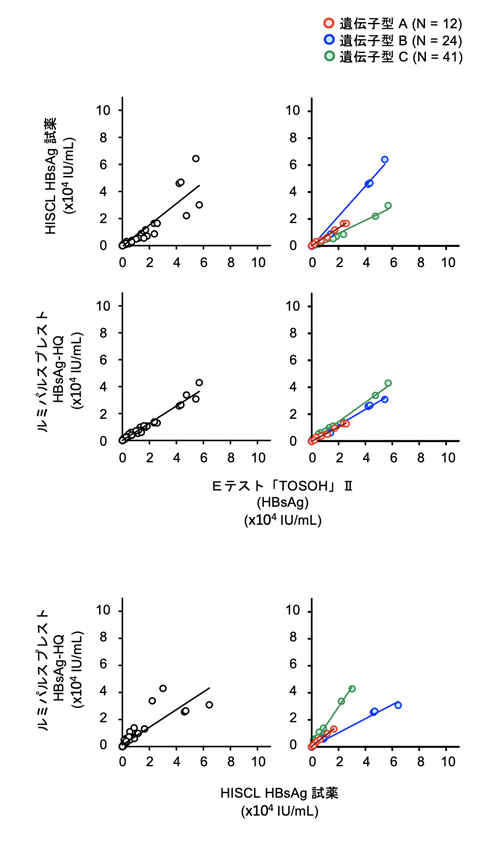
表1. HBsAg定量キット間における遺伝子型別の回帰係数と決定係数
|
アーキテクト・HBsAg QT との比較 |
全検体 | 遺伝子型 | |||
| A | B | C | |||
|
アキュラシード HBs抗原 |
回帰係数 | 1.22 | 0.540 | 1.33 | 1.31 |
| 決定係数 | 0.914 | 0.987 | 0.978 | 0.949 | |
|
BLEIA 栄研 HBs抗原 |
回帰係数 | 2.11 | 1.72 | 1.89 | 2.96 |
| 決定係数 | 0.933 | 0.997 | 0.998 | 0.981 | |
|
エクルーシス試薬 HBsAgⅡ quantⅡ |
回帰係数 | 0.856 | 0.783 | 0.823 | 1.00 |
| 決定係数 | 0.979 | 0.999 | 0.986 | 0.991 | |
|
Eテスト「TOSOH」 II (HBsAg) |
回帰係数 | 1.20 | 1.02 | 1.07 | 1.67 |
| 決定係数 | 0.939 | 0.991 | 0.997 | 0.988 | |
|
HISCL HBsAg 試薬 |
回帰係数 | 1.04 | 0.679 | 1.20 | 0.810 |
| 決定係数 | 0.941 | 0.997 | 0.992 | 0.980 | |
| ルミパルスプレスト HBsAg-HQ | 回帰係数 | 0.747 | 0.543 | 0.627 | 1.20 |
| 決定係数 | 0.868 | 0.995 | 0.996 | 0.984 | |
(4) 本検討で使用したHBV検体パネルについて
本検討で使用したHBV検体パネルは「献血血液等の研究開発等への使用に関する指針」に基づく公募により日本赤十字社から譲渡された献血血液を用いて作製されています。
D. 発表論文 (PubMedへのリンク)
Evaluation of in vitro screening and diagnostic kits for hepatitis B virus infection.
Murayama A, Momose H, Yamada N, Hoshi Y, Muramatsu M, Wakita T, Ishimaru K, Hamaguchi I, Kato T.
J Clin Virol. 2019 May 29; 117:37-42.doi: 10.1016/j.jcv.2019.05.011.
PMID: 31176210
E. 利益相反等について
上記論文の著者らは本研究について開示すべき事項はありません。
本論文の内容のホームページへの掲載はエルゼビア社の許諾を得ています。
C型肝炎ウイルス検体パネルを用いた性能評価(2022年)
- 詳細
A. 使用検体パネル
・HCV陽性検体パネル (2017);80検体
・HCV陰性検体パネル (2017);70検体
B. 評価キット
・HCV抗体キット;13キット
力価分類あり;7キット
力価分類なし;6キット
・HCV核酸キット;5キット
・HCVコア蛋白質キット;2キット
C.評価結果
(1) 各キットによるパネル検体の検出率
HCV抗体キット(力価分類あり)
|
|
陽性検体パネル (N=80) |
陰性検体パネル (N=70) |
|
ルミパルス HCV |
80 (100%) |
70 (100%) |
|
ルミパルスプレスト HCV |
80 (100%) |
70 (100%) |
|
ルミパルスII オーソ HCV |
80 (100%) |
70 (100%) |
|
ルミパルスプレスト オーソHCV |
80 (100%) |
70 (100%) |
|
アキュラシード HCV[II] |
80 (100%) |
70 (100%) |
|
HISCL HCV Ab 試薬 |
80 (100%) |
70 (100%) |
|
AIA−パックCL HCVAb |
80 (100%) |
70 (100%) |
HCV抗体キット(力価分類なし)
|
|
陽性検体パネル (N=80) |
陰性検体パネル (N=70) |
|
HCV・アボット(アーキテクト) |
80 (100%) |
70 (100%) |
|
Ab・アボット(Alinity) |
80 (100%) |
70 (100%) |
|
エクルーシス試薬 Anti-HCVⅡ |
80 (100%) |
70 (100%) |
|
ケミルミHCV抗体 |
80 (100%) |
70 (100%) |
|
HISCL HCV Ab II 試薬 |
80 (100%) |
70 (100%) |
|
Eテスト「TOSOH」II(HCVAb) |
80 (100%) |
70 (100%) |
HCVコア蛋白質キット
|
|
陽性検体パネル (N=80) |
陰性検体パネル (N=70) |
|
HCV Ag・アボット |
80 (100%) |
70 (100%) |
|
ルミパルス オーソHCV抗原 |
78 (97.5%) |
70 (100%) |
HCV核酸キット
|
|
陽性検体パネル (N=80) |
陰性検体パネル (N=70) |
|
アキュジーンm-HCV |
80 (100%) |
70 (100%) |
|
Alinity m システム HCV |
80 (100%) |
70 (100%) |
|
Cobas TaqMan HCV「オート」v2.0 |
80 (100%) |
70 (100%) |
|
コバス6800/8800 システム HCV |
80 (100%) |
70 (100%) |
|
アプティマ HCV |
80 (100%) |
70 (100%) |
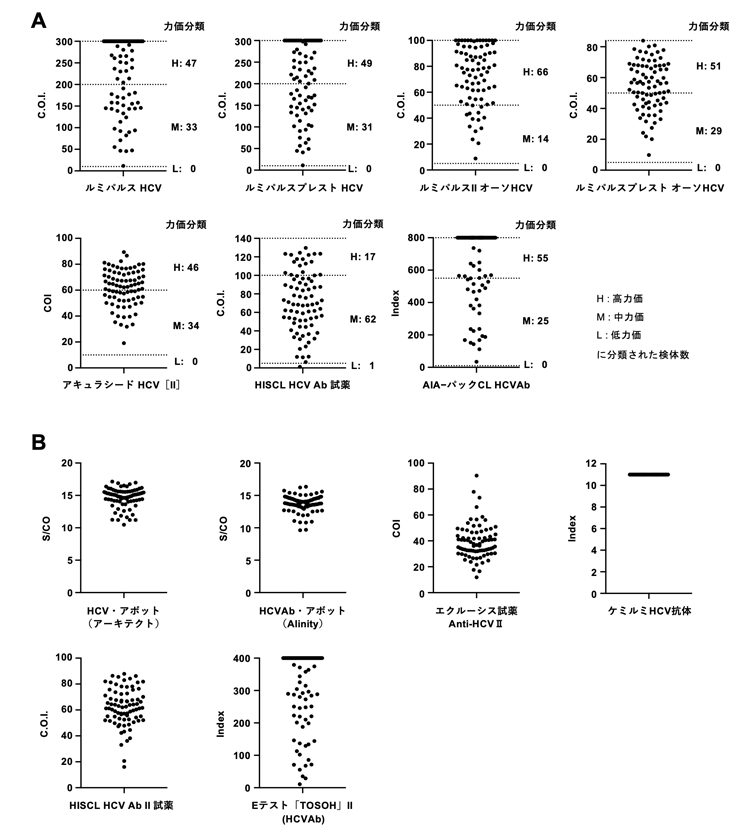
(2) HCV抗体キットによる測定
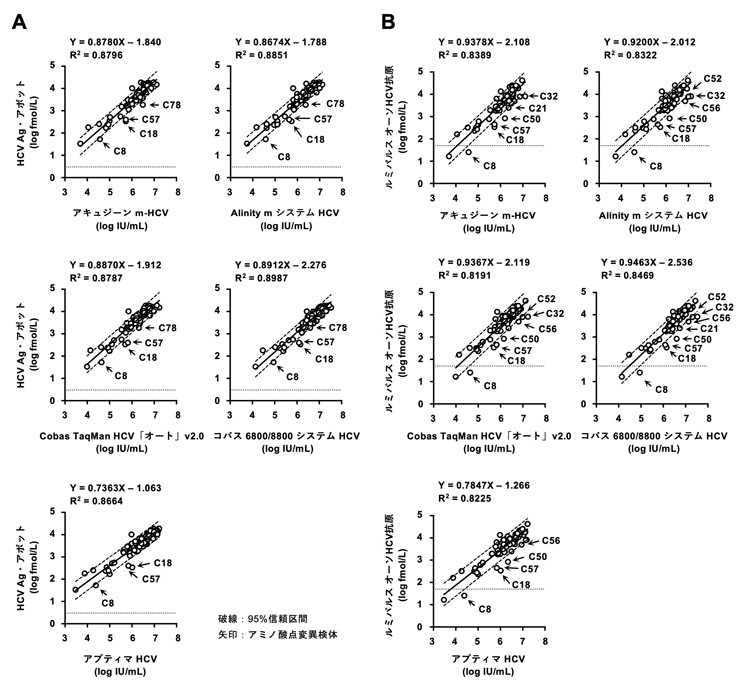
(3) HCV核酸キットの相関
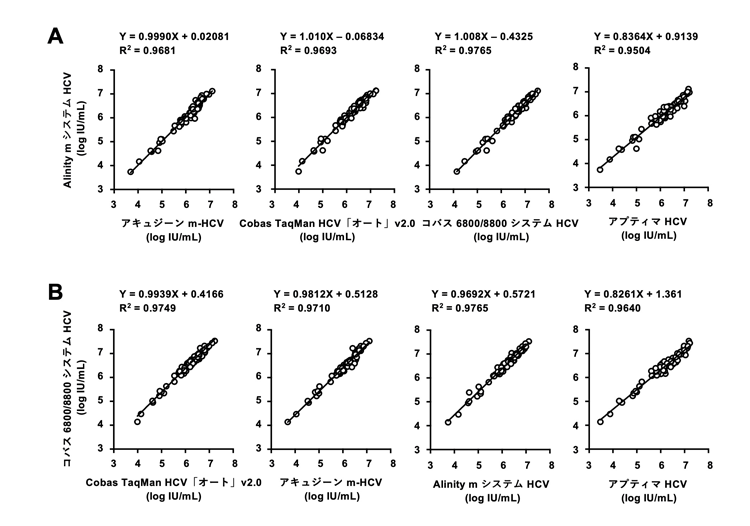
(4) HCVコア蛋白質キットの相関
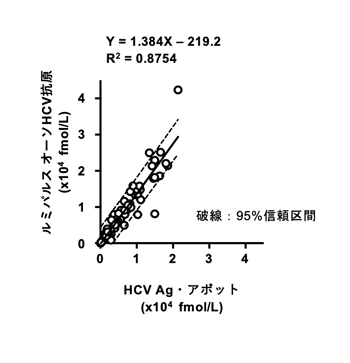
(5) HCV核酸キットとHCVコア蛋白質キットの相関
(6) 本検討で使用したHCV検体パネルについて
本検討で使用したHCV検体パネルは「献血血液等の研究開発等への使用に関する指針」に基づく公募により日本赤十字社から譲渡された献血血液を用いて作製されています。
また、本論文で検討を行ったHCVゲノムのコア領域の配列は以下のAccession No.で公開されています。
・LC658661- LC658679.
D.発表論文
Performance Evaluation of In Vitro Screening and Diagnostic Kits for Hepatitis C Virus Infection.
Murayama A, Momose H, Yamada N, Matsubayashi K, Muramatsu M, Hamaguchi I, Kato T.
Front Cell Infect Microbiol. 2022 Feb 3;11:793472. doi:10.3389/fcimb.2021.793472.
PMID: 35186779
本論文はCreative Commons Attribution License, CC-BY 4.0のもとに発表され、
Creative Commons CC0 1.0 Public Domain Dedication waiverのもと配信されました。
E.利益相反について
上記論文の著者らは本研究について開示すべき事項はありません。