お知らせ
感染症情報
研究・検査・病原体管理
サーベイランス
刊行・マニュアル・基準
- 詳細
厚生労働省発「A型肝炎発生届受理時の検体の確保等について」(平成22年4月26日健感発第0426第2号、食安監発0426第4号)に基づき、協力施設(下記参照)から当室に送付された検体または配列情報について分子疫学調査を実施しています。
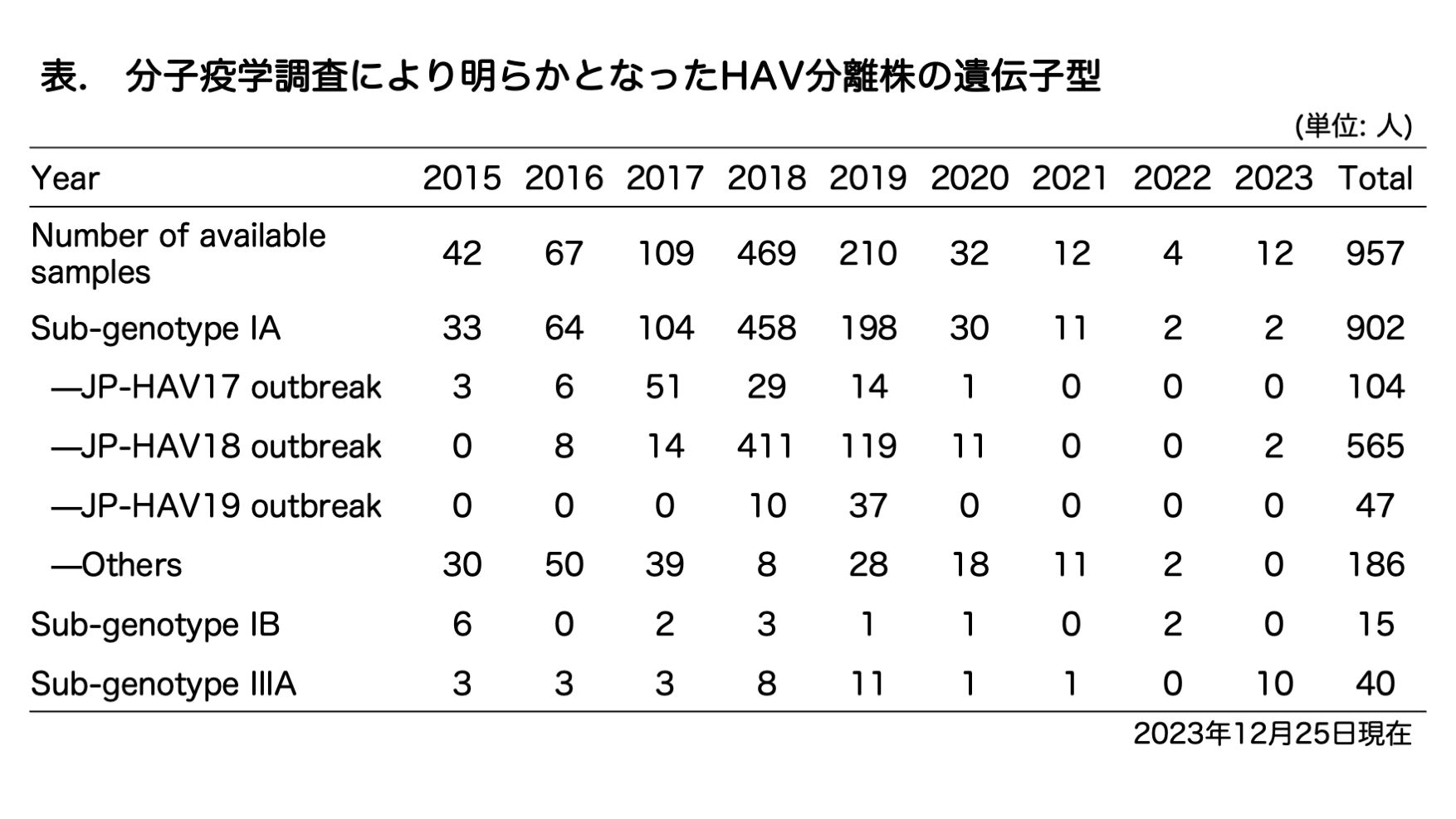
主要流行株について(詳細:病原体微生物検出情報(IASR)Vol. 40 No. 9, 2019年9月発行)
・JP-HAV17 (Accession No. LC415417):
この株の感染経路は汚染食品の摂取と推定された。長野県での小規模流行では、JP-HAV17株が検出された患者が喫食したものと同ロットの輸入冷凍アサリから同一株のウイルスが検出された(Tsukada R. et al. Jpn J Infect Dis. 2019. 72. 44-48)。
・JP-HAV18 (Accession No. LC777400):
この株は、台湾(2015-2016年)やヨーロッパ(2016-2017年)で男性同性間性的接触者(men who have sex with men: MSM)間で発生したA型肝炎流行株と遺伝子配列が同一であった。本邦での流行も、例年より男性患者の割合が高いことが特徴で、多くが男性同性間での性的接触を感染経路と報告している。汚染食品による感染経路を報告する患者は少なかった。急激な患者数の増加は都市部で顕著であった。
・JP-HAV19 (Accession No. LC777714):
2018年12月から2019年2月にかけて主に東北地方で検出された。この期間に急激な検出数の増加が見られ、一時的な流行を示していた。患者の大多数は食品媒介の感染経路を報告していたが、原因食材の特定には至らなかった。
|
ご協力頂いた施設一覧 |
|||
|
北海道立衛生研究所 |
藤沢市保健所 |
姫路市環境衛生研究所 |
広島市衛生研究所 |
|
札幌市衛生研究所 |
川崎市健康安全研究所 |
三重県保健環境研究所 |
広島市保健所 |
|
青森県環境保健センター |
横浜市衛生研究所 |
滋賀県衛生科学センター |
香川県環境保健研究センター |
|
岩手県環境保健研究センター |
新潟県保健環境科学研究所 |
京都市衛生環境研究所 |
高松市保健所 |
|
仙台市衛生研究所 |
新潟市衛生環境研究所 |
大阪健康安全基盤研究所 |
愛媛県立衛生環境研究所 |
|
宮城県保健環境センター |
富山県衛生研究所 |
堺市衛生研究所 |
福岡県保健環境研究所 |
|
秋田県健康環境センター |
富山県新川厚生センター |
尼崎市立衛生研究所 |
北九州市保健福祉局 |
|
福島県衛生研究所 |
石川県保健環境センター |
西宮市保健所 |
久留米市保健所 |
|
茨城県衛生研究所 |
長野県環境保全研究所 |
神戸市健康科学研究所 |
福岡市保健環境研究所 |
|
前橋市保健所 |
岐阜県保健環境研究所 |
奈良県保健研究センター |
佐賀県衛生薬業センター |
|
川口市保健所 |
岐阜市衛生試験所 |
和歌山県環境衛生研究センター |
長崎市保健所 |
|
埼玉県衛生研究所 |
静岡県環境衛生科学研究所 |
和歌山市衛生研究所 |
大分県衛生環境研究センター |
|
千葉県衛生研究所 |
静岡市環境保健研究所 |
鳥取県衛生環境研究所 |
宮崎県衛生環境研究所 |
|
千葉市環境保健研究所 |
浜松市保健環境研究所 |
島根県保健環境科学研究所 |
鹿児島県環境保健センター |
|
船橋市保健所 |
愛知県衛生研究所 |
岡山市保健所 |
鹿児島市保健所 |
|
東京都健康安全研究センター |
豊橋市保健所 |
倉敷市保健所 |
沖縄県衛生環境研究所 |
- 詳細
- はじめに
このホームページは肝炎ウイルスに関する情報を提供する目的で開設されました。肝炎ウイルスの専門家および肝臓専門医の方から、一般の方々にも役に立つ情報源となることを目指しております。 ウイルス第二部は下痢症をおこすウイルス、ポリオウイルスをはじめとするエンテロウイルス、肝炎ウイルスを担当しています。これらのウイルスに関する基礎研究や、ウイルスに起因すると考えられる疾患についての研究を行っていますが、ここでは主に肝炎ウイルスについての情報を発信します。個々のウイルスについて、できるだけ理解が深まるように内容を充実させていく予定です。
国立感染症研究所・ウイルス第二部 村松 正道
- 詳細
- World Health Organization, Department of Communicable Disease Surveillance and Response. Hepatitis B (WHO/CDS/CSR/LYO/2002.2). http://www.who.int/emc, 2002
- 平松憲,茶山一彰. 急性B型肝炎. ウイルス肝炎update, 白鳥康史編, 中外医学社: pp 3-6, 2005
- 八橋弘.感染症:最近の世界の現状「B型肝炎」.臨床と微生物:33(4):367-372,2006.
- 矢野右人. B型肝炎・D型肝炎. 肝臓病学, 戸田剛太郎他編, 医学書院: pp 306-316, 1998
- 柘植雅貴,茶山一彰. HBc抗体(IgM・HBc抗体・IgA・HBc抗体を含む). 日本臨床; 62: 129-133, 2004
- Orito E, Ichida T, Sakugawa H, et al. Geographic distribution of hepatitis B virus (HBV) genotype in patients with chronic HBV infection in Japan. Hepatology; 34(3): 590-594, 2001
- 厚生労働省国立感染症研究所感染症情報センター. B型肝炎 2006年7月現在. IASR 2006; 27(9) https://idsc.niid.go.jp/iasr/27/319/inx319-j.html
- 鈴木哲朗. 感染症の話「B型肝炎」.感染症発生動向調査週報. https://idsc.niid.go.jp/idwr/kansen/k04/K04_15/k04_15.html, 2004
- 木村三生夫,平山宗宏,堺春美. B型肝炎. 予防接種の手引き〈第11版〉, 近代出版: pp 302-303, 2006
- 吉澤浩司. 肝炎ウイルス無症候性キャリアの動向.肝がん白書(平成11年度).社団法人日本肝臓学会: pp23-32, 1999
- 田尻仁. 任意接種対象疾患「B型肝炎ワクチン」. 臨床と微生物: 32(5) : 489-491, 2005
- ハリソン内科学 第2版,日本語版監修; 福井次矢, 黒川 清.メディカル・サイエンス・インターナショナル
- Bartholomeusz A, Schaefer S. Hepatitis B virus genotypes: comparison of genotyping methods. Rev Med Virol; 14: 3-16, 2004
- Hollinger FB, Liang TJ. Hepatitis B virus. In: Knipe DM et al., eds. Fields Virology, 4th ed. Lippincott Williams & Wilkins, Philadelphia: pp 2971-3036, 2001
- 小山富子,佐々木純子,内田茂治.岩手県におけるB型肝炎ウイルス・C型肝炎ウイルスの感染状況について -出生年コホート別にみた解析−.厚生労働科学研究費補助金(肝炎等克服緊急対策研究事業)「肝炎状況・長期予後の疫学に関する研究」;班研究報告書・平成21年度分担研究報告書: 179-197,2010
- 吉澤浩司.肝炎ウイルス(HBVとHCV)の母子感染と対策.肝胆膵:55(2):237-244,2007
- Yoshikawa A, Suzuki K, Abe A, et. al. Effect of selective vaccination on a decrease in the rate of hepatitis B virus-positive Japanese first-time blood donors. Transfusion Medocine; 19: 172-179, 2009
- 田中憲一,芹川武大,水落利明.HBワクチンの効果に関する臨床的検討.厚生労働科学研究費補助金(肝炎等克服緊急対策研究事業)「肝炎ウイルス感染防御を目指したワクチン接種の基盤構築」;班研究報告書・平成19-21年度総合研究報告書: 9-34,2010
- 岡部信彦,多田有希,水落利明.B型肝炎の発生動向.厚生労働科学研究費補助金(肝炎等克服緊急対策研究事業)「肝炎ウイルス感染防御を目指したワクチン接種の基盤構築」;班研究報告書・平成19-21年度総合研究報告書: 48-55,2010
- 20.八橋 弘,石橋大海,矢野公士他.本邦におけるウイルス性急性肝炎の発生状況と治療法に関する研究.国立病院機構共同臨床研究;平成18年度研究報告書:1-8, 2006
- 21.佐賀県健康増進課:保育所におけるB型肝炎集団発生調査報告書について http://www.kansen.pref.saga.jp/kisya/kisya/hb/houkoku160805.htm
- 22.乾あやの,小松陽樹,菅原秀典他.B型肝炎の家族内感染例.病原微生物検出情報(IASR)Vol.31: p21-22:2010
- 23.坪内博仁,桶谷真,井戸章雄,他.劇症肝炎及び遅発性肝不全(LOHF:late onset hepatic failure)の全国集計(2007年).厚生労働省科学研究費補助金(難治性疾患克服研究事業)「難治性の肝・胆道疾患に関する調査研究」平成20年度研究報告書: 83-93, 2008
- 青柳豊,西口修平,道堯浩二郎他.本邦の肝硬変の成因と現状 第44回日本肝臓学会総会 主題ポスター「肝硬変の成因別実態」のまとめ.肝硬変の成因別実態2008.監修, 恩地森一,中外医学書: pp 1-10, 2008
- 工藤正俊,有井滋樹,猪飼伊和夫他.第17回全国原発性肝癌追跡調査報告(2002〜2003)(日本肝癌研究会追跡調査委員会).肝臓; 48(3): 117-140. 2007
- Yang Baoping. International Expert Meeting on Hepatitis B Control in the West Pacific, Seoul, 24-25 Nov 2008
- World Health Organization,http:gamapserver.who.int/mapLibrary/Files/Maps/Global_HepB_ITHRiskMap.png
- Daniels D, Grytdal S, Wasley A. Surveillance for acute viral hepatitis --- United States, 2007. MMWR Surveillance Summaries; 58 (SS03): 1-27, 2009
- World Health Organization, http://www.who.int/immunization_monitoring/diseases/hepatitis/en/index.html
- Rentala M, van de Laar, MJ. Surveillance and epidemiology of hepatitis B and C in Europe – a review. Euro Surveill. 2008; 13(21): pii=18880. Available online, http://www.eurosurveillance.org/ViewArticle.aspx?Articled=18880
- International Expert Meeting on Hepatitis B Control in the West Pacific, Seoul, 24-25 Nov 2008; Meeting Report, 2009
- Tilson L, Thornton L, O'Flanagan D, Johnson H, Barry M. : Cost effectiveness of hepatitis B vaccination strategies in Ireland: an economic evaluation. Eur J Public Health. 2008 Jun;18(3):275-82.
- Aono J, Yotsuyanagi H, Miyoshi H, et al. Amino acid substitutions in the S region of hepatitis B virus in sera from patients with acute hepatitis. Hepatol Res: 37(9): 731-739, 2007
- Hsu HY, Chang MH, Ni YH, Chiang CL, Chen HL, Wu JF, Chen PJ.: No increase in prevalence of hepatitis B surface antigen mutant in a population of children and adolescents who were fully covered by universal infant immunization. J Infect Dis. 2010 Apr 15;201(8):1192-200.
- Centers for Disease Control and Prevention (CDC). A comprehensive immunization strategy to eliminate transmission of hepatitis B virus infection in the United States. MMWR Morb Mortal Wkly Rep. Recommendations and Reports; 54(RR16), 2005
- Lin YC, Chang MH, Ni YH, et al. Long-Term Immunogenicity and efficacy of universal hepatitis B virus vaccination in Taiwan. JID; 187: 134-138, 2003
- Mineta M, Tanimura M, Tana T. et al. Contribution of HLA class I and class II alleles to the regulation of antibody production to hepatitis B surface antigen in humans. Int Immunol; 8(4): 525-531, 1995
- 袖山健,小林正和.HBV感染予防効果と安全性.日本臨床; 62(増刊号8): 216-221, 2004
- Nommensen FE, Go ST, Maclaren DM. Half-life of HBs antibody after hepatitis B vaccination: an aid to timing of booster vaccination. The Lancet: 847-849, 1989
- Denis F, Levy-Bruhl D. Mass vaccination against hepatitis B: The French example. In: Plotkin SA ed. Mass vaccination: Global aspects – progress and obstacles. Springer-Verlag, Berlin Heidelberg, CTMI304: pp 115-129, 2006
- 詳細
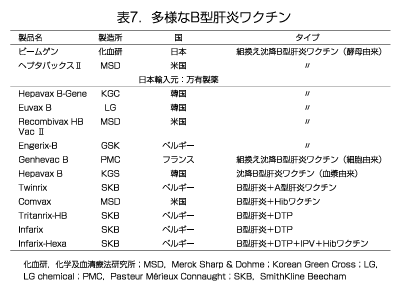
1)ワクチンの種類
組換え沈降B型肝炎ワクチンは20年以上前に認可され、世界中で使用されている(表7)。効果も安全性も高いワクチンである1)。現在、日本では酵母由来の組換え沈降B型肝炎ワクチン2種類(化学及血清療法研究所「ビームゲン」、万有製薬(製造元;米国メルク社)「ヘプタバックスⅡ」)が販売されている9, 33)。母子感染予防、医療従事者、高頻度国への渡航者などハイリスク群対策が主な使用目的の日本では混合ワクチンの開発は行われていない。海外では小児期の接種回数を減らすために、単味ワクチンに加えて各種の混合ワクチンが使用されている。
1)製剤としての特性、安全性、副作用、有効性、抗体持続時間、接種スケジュール(国外のケース)、キャッチアップの必要性等
(1)特性
遺伝子組み換え技術を応用して酵母で産生したHBs抗原をアジュバント(アルミニウム塩)に吸着させた沈降不活化ワクチンである。海外では酵母由来製剤に加えて細胞由来製剤や他の製剤と組み合わせた混合ワクチンも認可されている。
(2)安全性
長く世界中で使われているが、安全性の問題が起こったことはない。ワクチン接種によるHBVエスケープミュータント(中和抵抗性変異ウイルス株)の発生が危惧されているが、エスケープミュータントはHBV自然感染下でも発生する。これについては現在も研究が進められている1)。現在の標準的な見解では、「ユニバーサルワクチネーション実施下では、HBVエスケープミュータントが一定の割合で検出されるが、そのような変異株が広がる兆候はみられない。」とされている34)。
(3)副反応
5%以下の確率で、発熱、発疹、局所の疼痛、かゆみ、腫脹、硬結、発赤、吐き気、下痢、食欲不振、頭痛、倦怠感、関節痛、筋肉痛、手の脱力感などが見られる9)。いずれも数日で回復する。ワクチン成分(酵母)に対するアレルギー反応がある人はHBIGを選択するが、予防効果は短期間である。多発性硬化症などいくつかの副作用の疑いが報告されてきたがいずれも科学的な根拠は否定されている1, 35) 。
(4)有効性
若いほど抗体獲得率が高い傾向にある。40歳までの抗体獲得率は95%、40〜60歳で90%、60歳以上になると65〜70%に落ちる1)。
HBV曝露後には早期(7〜14日後まで)にHBIGの筋肉内接種に加えてB型肝炎ワクチンを接種すれば感染予防効果が期待される1, 35)。
また、HBVキャリア化予防効果については、台湾で1,200人の児童を対象にして、ワクチン接種時の7歳から7年後の14歳まで経過観察を行ったデータがある。これによると、対象者のうち、経過観察期間中に11人がHBV感染していたことが判明した(HBc抗体陽転)が、HBVキャリア化した児童はいなかった36)。
B型肝炎ワクチンは全接種者の10%前後のnon responder、 low responderが見られる37, 38)。この場合は追加接種、高用量接種、接種方法変更(皮内接種)などで対応する。
遺伝子型が異なるウイルスに対するワクチンの有効性は今のところ不明である。遺伝子型が異なっていても血清型が重複し、血清型間の交差反応が認められていることからある程度の有効性は期待できる。また、自然感染において異なる遺伝子型ウイルスの重複感染が大きな社会問題となったことはない。しかしながら、遺伝子型が異なるウイルスの抗原エピトープの立体構造がワクチン株と異なる場合、ワクチンによる感染防御能が弱くなる可能性があるという研究結果もある33)。前述のエスケープミュータントの問題も含めて、今後の検討が必要である。
(5)抗体持続時間
ワクチン3回接種後の防御効果は20年以上続くと考えられている。抗体持続期間は個人差が大きい。3回接種完了後の抗体価が高い方が持続期間も長い傾向がある39)。
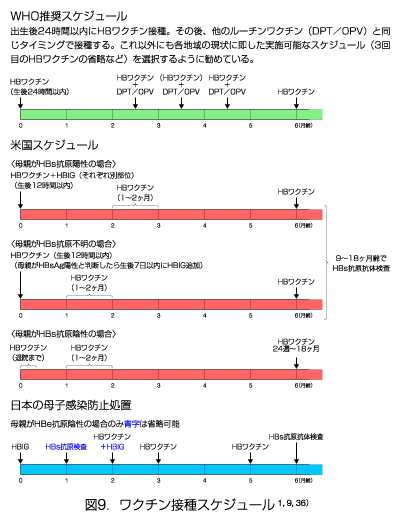
(6)接種スケジュール
B型肝炎ワクチンは3回接種で完了する(HepB3)。一般的な接種スケジュールは0、1、6ヶ月に筋肉内又は皮下接種する。免疫不全、血液透析患者等は4回接種スケジュールや高用量ワクチンを検討する。
日本のワクチンの場合、目的によって以下の投与法が推奨されている9)。いずれも3回接種後にHBs抗体が獲得されていない場合には追加注射する。
B型肝炎の予防:通常、0.5mlずつを4週間隔で2回、更に20〜24週を経過した後に1回0.5mlを皮下又は筋肉内に注射する。ただし、10歳未満の者には、0.25mlずつを同様の投与間隔で皮下に注射する。
B型肝炎ウイルス母子感染の予防(HBIGとの併用):通常0.25mlを1回、生後2〜3ヶ月に皮下に注射する。更に0.25mlずつを初回注射の1ヶ月後及び3ヶ月後の2回、同様の用法で注射する(図9)。
HBs抗原陽性でかつHBe抗原陽性の血液による汚染事故後のB型肝炎発症予防(HBIGとの併用):通常、0.5mlを1回、事故発生後7日以内に皮下又は筋肉内に注射する。更に0.5mlずつを初回注射の1ヶ月後及び3〜6ヶ月後の2回、同様の方法で注射する。なお、10歳未満の者には、0.25mlずつを同様の投与間隔で皮下に注射する。
特に小児の投与について、WHO推奨スケジュール1) 、米国スケジュール36)と日本の母子感染防止処置9)を図9に示した。
(7)キャッチアップの必要性
ハイリスク群や、ユニバーサルワクチネーションを導入している場合は導入前に生まれたワクチン未接種の児童へのワクチネーション(キャッチアップ)はB型肝炎コントロールの手段として効果的である。米国では11〜12歳児のワクチン接種履歴の確認とワクチン接種の完了、身近な医療機関でB型肝炎ワクチン接種を受けられる環境の整備、州による就学時のワクチン接種完了要請などを推奨している36)。フランスでは1995〜2004年の間に20歳以下の接種率を上げる目的で、0〜2歳のユニバーサルワクチネーションと11歳のキャッチアップを導入した。しかしながら、1998〜2002年の間、副作用の疑いからキャッチアップをやめて任意接種にしたところ、この期間中に11歳の接種を受けるはずだった児童のワクチン接種率(HepB3)がそれまでキャッチアップ対象だった児童の46.2%から半分の23.3%に低下した40)。