お知らせ
感染症情報
研究・検査・病原体管理
サーベイランス
刊行・マニュアル・基準
- 詳細
- 詳細
| ■ご覧いただく前に | |
| 各章毎にPDFファイルで収録しておりま す。 ご覧になるには、Adobe Reader6以上を推奨致します。 |
|
- 詳細
Neutralizing-antibody-independent SARS-CoV-2 control correlated with intranasal-vaccine-induced CD8+ T cell responses
Ishii H, Nomura T, Yamamoto H, Nishizawa M, Hau TTT, Harada S, Seki S, Nakamura-Hoshi M, Okazaki M, Daigen S, Kawana-Tachikawa A, Nagata N, Iwata-Yoshikawa N, Shiwa N, Suzuki T, Park ES, Maeda K, Onodera T, Takahashi Y, Kusano K, Shimazaki R, Suzaki Y, Ami Y, Matano T.
Cell Rep. Med. 3: 100520, 2022
現行の新型コロナワクチンは、スパイク抗原(S)に対する中和抗体反応誘導を目的とするものであるが、中和抗体抵抗性S変異株の出現によりワクチン有効性が半減することが問題となっている。T細胞誘導効果も期待されているが、その感染制御効果は明らかとなっていなかった。本研究では、動物実験にて、S以外の抗原(N、M、E)を発現する経鼻ワクチンの新型コロナウイルス感染制御効果を解析した。その結果、ワクチン接種群では、経鼻チャレンジ後の鼻咽頭ぬぐい液中ウイルス量が有意に低下し、その感染制御効果はワクチン誘導CD8陽性T細胞反応と相関することが明らかとなった。本研究成果は、ワクチン誘導CD8陽性T細胞の新型コロナウイルス感染制御効果を初めて示すものであり、S変異株に対するワクチン開発に結びつくことが期待される。
- 詳細
A. 使用検体パネル
・HCV陽性検体パネル (2017);80検体
・HCV陰性検体パネル (2017);70検体
B. 評価キット
・HCV抗体キット;13キット
力価分類あり;7キット
力価分類なし;6キット
・HCV核酸キット;5キット
・HCVコア蛋白質キット;2キット
C.評価結果
(1) 各キットによるパネル検体の検出率
HCV抗体キット(力価分類あり)
|
|
陽性検体パネル (N=80) |
陰性検体パネル (N=70) |
|
ルミパルス HCV |
80 (100%) |
70 (100%) |
|
ルミパルスプレスト HCV |
80 (100%) |
70 (100%) |
|
ルミパルスII オーソ HCV |
80 (100%) |
70 (100%) |
|
ルミパルスプレスト オーソHCV |
80 (100%) |
70 (100%) |
|
アキュラシード HCV[II] |
80 (100%) |
70 (100%) |
|
HISCL HCV Ab 試薬 |
80 (100%) |
70 (100%) |
|
AIA−パックCL HCVAb |
80 (100%) |
70 (100%) |
HCV抗体キット(力価分類なし)
|
|
陽性検体パネル (N=80) |
陰性検体パネル (N=70) |
|
HCV・アボット(アーキテクト) |
80 (100%) |
70 (100%) |
|
Ab・アボット(Alinity) |
80 (100%) |
70 (100%) |
|
エクルーシス試薬 Anti-HCVⅡ |
80 (100%) |
70 (100%) |
|
ケミルミHCV抗体 |
80 (100%) |
70 (100%) |
|
HISCL HCV Ab II 試薬 |
80 (100%) |
70 (100%) |
|
Eテスト「TOSOH」II(HCVAb) |
80 (100%) |
70 (100%) |
HCVコア蛋白質キット
|
|
陽性検体パネル (N=80) |
陰性検体パネル (N=70) |
|
HCV Ag・アボット |
80 (100%) |
70 (100%) |
|
ルミパルス オーソHCV抗原 |
78 (97.5%) |
70 (100%) |
HCV核酸キット
|
|
陽性検体パネル (N=80) |
陰性検体パネル (N=70) |
|
アキュジーンm-HCV |
80 (100%) |
70 (100%) |
|
Alinity m システム HCV |
80 (100%) |
70 (100%) |
|
Cobas TaqMan HCV「オート」v2.0 |
80 (100%) |
70 (100%) |
|
コバス6800/8800 システム HCV |
80 (100%) |
70 (100%) |
|
アプティマ HCV |
80 (100%) |
70 (100%) |
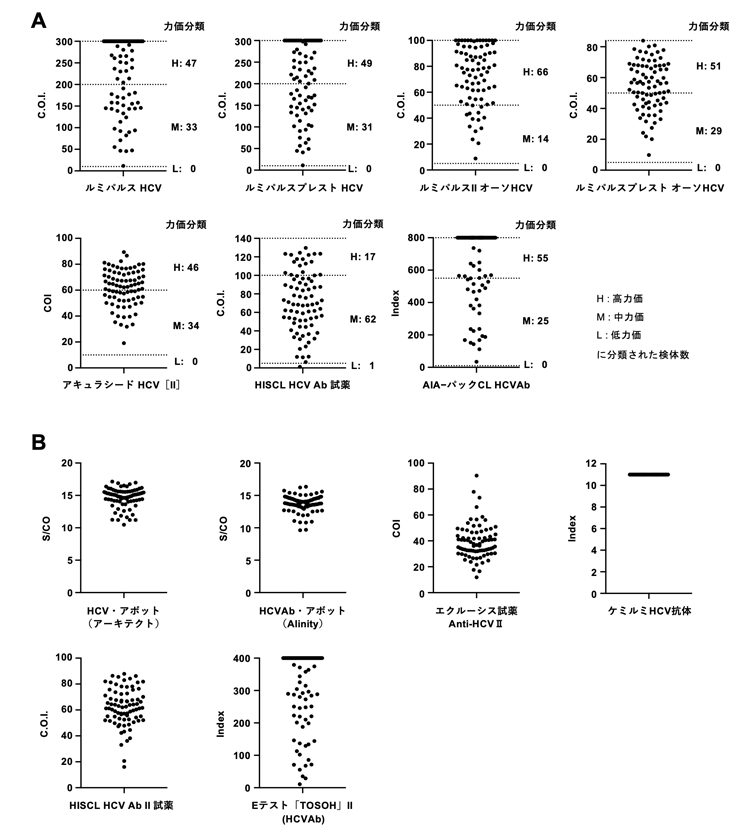
(2) HCV抗体キットによる測定
(3) HCV核酸キットの相関
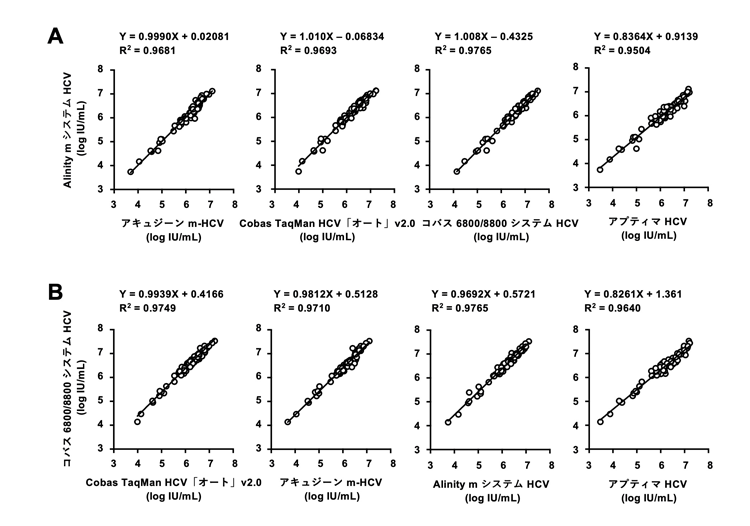
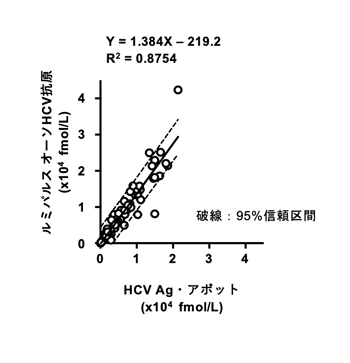
(4) HCVコア蛋白質キットの相関
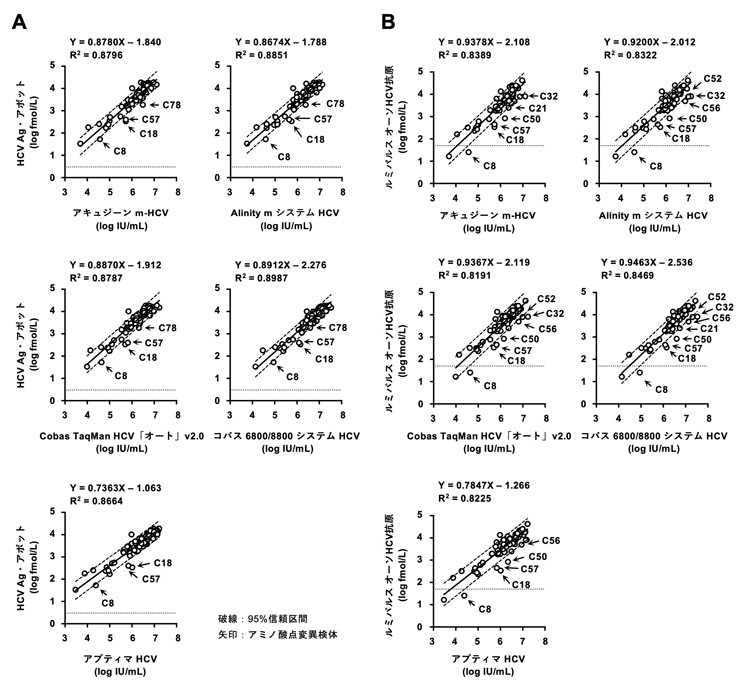
(5) HCV核酸キットとHCVコア蛋白質キットの相関
(6) 本検討で使用したHCV検体パネルについて
本検討で使用したHCV検体パネルは「献血血液等の研究開発等への使用に関する指針」に基づく公募により日本赤十字社から譲渡された献血血液を用いて作製されています。
また、本論文で検討を行ったHCVゲノムのコア領域の配列は以下のAccession No.で公開されています。
・LC658661- LC658679.
D.発表論文
Performance Evaluation of In Vitro Screening and Diagnostic Kits for Hepatitis C Virus Infection.
Murayama A, Momose H, Yamada N, Matsubayashi K, Muramatsu M, Hamaguchi I, Kato T.
Front Cell Infect Microbiol. 2022 Feb 3;11:793472. doi:10.3389/fcimb.2021.793472.
PMID: 35186779
本論文はCreative Commons Attribution License, CC-BY 4.0のもとに発表され、
Creative Commons CC0 1.0 Public Domain Dedication waiverのもと配信されました。
E.利益相反について
上記論文の著者らは本研究について開示すべき事項はありません。
- 詳細
Lewis fucose is a key moiety for the recognition of histo-blood group antigens by GI.9 norovirus, as revealed by structural analysis
Tomomi Kimura-Someya, Miyuki Kato-Murayama, Kazushige Katsura, Naoki Sakai, Kazutaka Murayama, Kazuharu Hanada, Mikako Shirouzu, Yuichi Someya
FEBS Open Bio, 2022, 12(3), 560–570.
https://febs.onlinelibrary.wiley.com/doi/10.1002/2211-5463.13370
ノロウイルスはヒトのウイルス性胃腸炎の主たる原因ウイルスであり、その感染には組織血液型抗原(HBGA)が重要と考えられている。GI.9ノロウイルスはGIノロウイルスの中で最も新しい遺伝子型である。VLPを用いてHBGA結合アッセイを行ったところ、GI.9ノロウイルスはABH抗原ではなく、ルイス抗原に結合することが明らかになった。更に、ルイス抗原存在下でVP1キャプシドタンパク質のPドメイン領域のX線結晶構造解析を行い、ルイス抗原中のルイスフコース(α1–3/4フコース)残基が主にPドメインに認識されることを見出した。このことからルイス抗原がノロウイルスの感染成立に極めて重要であることが示唆される。本研究の成果はノロウイルスに対する治療薬やワクチンのデザインに有用と期待される。
- 詳細
SARS-CoV-2 Omicron-neutralizing memory B-cells are elicited by two doses of BNT162b2 mRNA vaccine
Ryutaro Kotaki†, Yu Adachi†, Saya Moriyama†, Taishi Onodera†, Shuetsu Fukushi, Takaki Nagakura, Keisuke Tonouchi, Kazutaka Terahara, Lin Sun, Tomohiro Takano, Ayae Nishiyama, Masaharu Shinkai, Kunihiro Oba, Fukumi Nakamura-Uchiyama, Hidefumi Shimizu, Tadaki Suzuki, Takayuki Matsumura, Masanori Isogawa, Yoshimasa Takahashi († These authors contributed equally)
Science Immunology (2022), DOI: 10.1126/sciimmunol.abn8590
mRNAワクチン2回接種後に、オミクロン株に対して中和活性を有する抗体が記憶B細胞に保存されていることを見出しました。今回の発見により、3回接種やブレークスルー感染によってオミクロン中和活性をもつ抗体が血液中に産生されるメカニズムの解明につながることが期待されます。
オミクロン株は多くのアミノ酸変異によりmRNAワクチン2回接種後に誘導される血液抗体から強く逃避しますが、3回接種やブレークスルー感染後の血液にはオミクロン中和抗体が誘導されることが報告されています。本研究では、mRNAワクチン2回接種後に誘導された記憶B細胞を取り出し、この細胞に保存されている抗体を解析しました。すると、中和活性をもつ抗体のうち、約30%の抗体がオミクロン株への中和活性を保持していることを明らかとしました。ワクチン3回接種やブレークスルー感染後には、これら記憶B細胞が反応してオミクロン株に対する中和抗体を血液中に産生する可能性が示唆されます。
本内容はAMEDの研究支援を受けて実施しました。
続きを読む: SARS-CoV-2オミクロン株を中和する記憶B細胞はBNT162b2 mRNAワクチンの2回接種により誘導される
