A. 使用検体パネル
・HBV陽性検体パネル (2019);80検体
・HBV陰性検体パネル (2019);64検体
B. 評価キット
・HBV核酸キット;5キット
・HBs抗原キット;14キット
定量;8キット
定性;4キット
イムノクロマト;2キット
C. 評価結果
(i) 各キットによるパネル検体の検出率
HBV核酸キット
|
|
陽性検体パネル (N=80) |
陰性検体パネル (N=64) |
|
アキュジーンm-HBV |
80 (100%) |
64 (100%) |
|
Alinity m システム HBV |
79 (98.8%) |
64 (100%) |
|
コバス TaqMan HBV「オート」v2.0 |
79 (98.8%) |
62 (96.9%) |
|
コバス6800/8800 システム HBV |
79 (98.8%) |
63 (98.4%) |
|
アプティマ HBV |
80 (100%) |
64 (100%) |
HBs抗原キット(定量)
|
|
陽性検体パネル (N=80) |
陰性検体パネル (N=64) |
|
ルミパルス HBsAg-HQ |
80 (100%) |
64 (100%) |
|
ルミパルスプレスト HBsAg-HQ |
80 (100%) |
64 (100%) |
|
HISCL HBsAg試薬 |
80 (100%) |
64 (100%) |
|
AIA-パックCL HBsAg |
80 (100%) |
64 (100%) |
|
アキュラシード HBs抗原 |
80 (100%) |
64 (100%) |
|
HBsAg QT・アボット(アーキテクト) |
80 (100%) |
64 (100%) |
|
HBsAg QT・アボット(Alinity) |
80 (100%) |
64 (100%) |
|
エクルーシス試薬 HBsAg II quant II |
80 (100%) |
64 (100%) |
HBs抗原キット(定性)
|
|
陽性検体パネル (N=80) |
陰性検体パネル (N=64) |
|
Eテスト「TOSOH」II (HBsAg) |
79 (98.8%) |
64 (100%) |
|
ステイシア CLEIA HBs抗原 |
79 (98.8%) |
64 (100%) |
|
ケミルミ HBs抗原II |
80 (100%) |
64 (100%) |
|
エクルーシス試薬 HBsAg II |
80 (100%) |
64 (100%) |
HBs抗原キット(イムノクロマト)
|
|
陽性検体パネル (N=80) |
陰性検体パネル (N=64) |
|
ダイナスクリーン・HBsAg II |
75 (93.8%) |
64 (100%) |
|
ダイナスクリーン HBsAg 2 Plus |
80 (100%) |
64 (100%) |
(ii) HBV核酸キットの相関
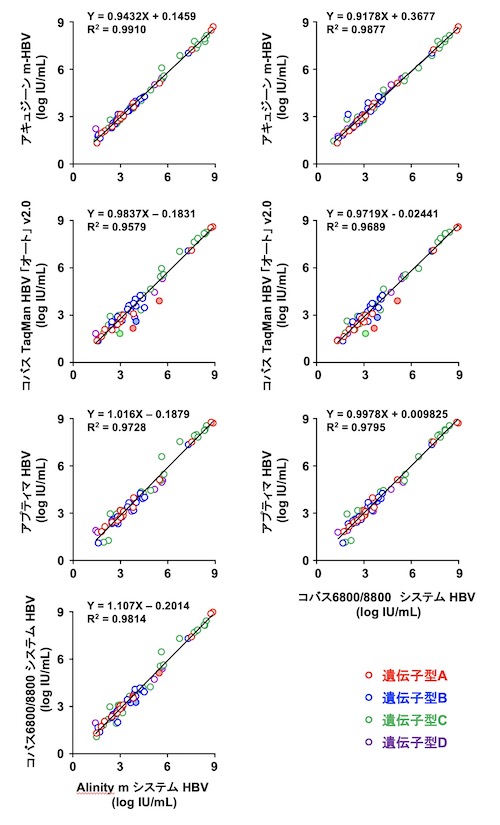
(iii) HBs抗原キットの相関
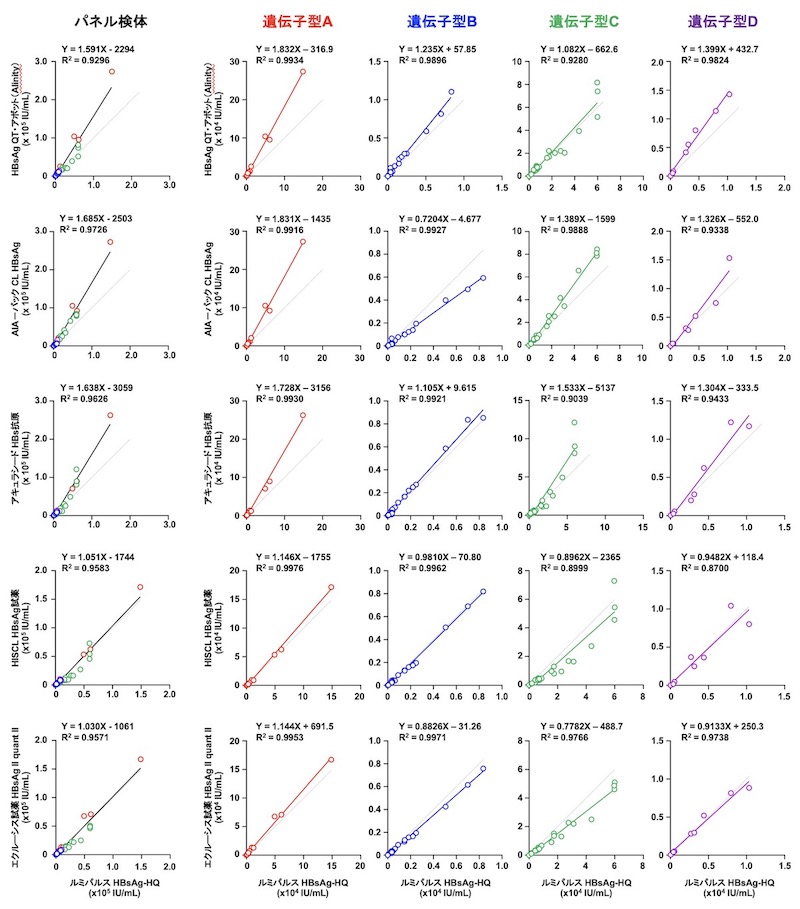
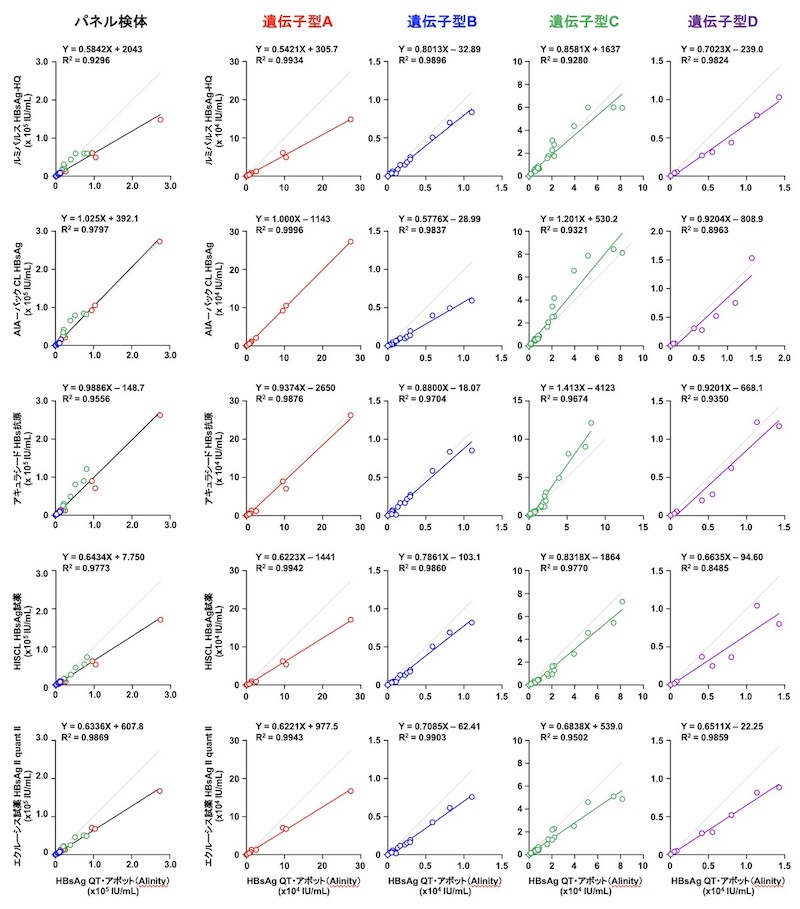
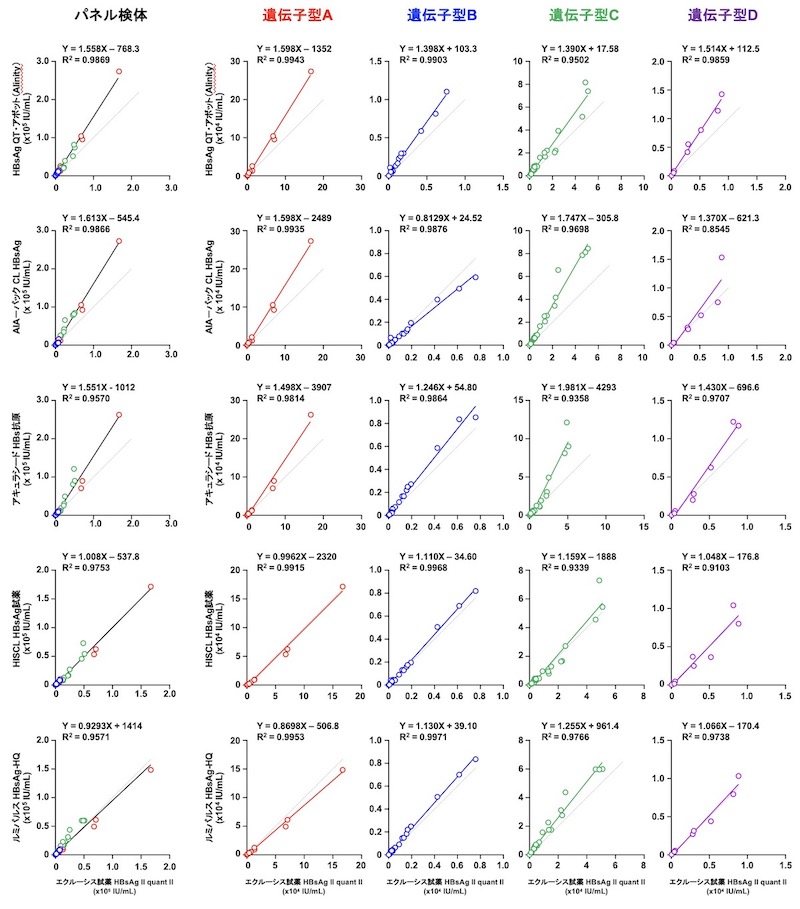
D. 本検討で使用したHBV検体パネルについて
本検討で使用したHCV検体パネルは「献血血液等の研究開発等への使用に関する指針」に基づく公募により日本赤十字社から譲渡された献血血液を用いて作製されています。
E. 発表論文
Momose H, Murayama A, Yamada N, Matsubayashi K, Matsuoka S, Ikebe E, Kuramitsu M, Muramatsu M, Kato T, Hamaguchi I.
Virol J. 2023 May 10;20(1):93. doi: 10.1186/s12985-023-02054-7.
PMID: 37165426
本論文はCreative Commons Attribution License, CC-BY 4.0のもとに発表され、Creative Commons CC0 1.0 Public Domain Dedication waiverのもと配信されました。
F. 利益相反について
上記論文の著者らは本研究について開示すべき事項はありません。