国内でよくみられる侵襲性真菌症
~カンジダ症~
2019年の「真菌症週間」について
“真菌感染症への気付き”を推進する週です。この取り組みは米国疾病予防管理センター(CDC)の呼びかけにより、各国各地域で問題となる真菌症の認知度をあげ、重症の真菌感染症の患者さんの救命につなげることを目的としています。
2019年の真菌症週間は9月23日~27日で、日本ではカンジダ症を取り上げます。表在性真菌症である口腔咽頭カンジダ症は、エイズ指標疾患のなかでも国内ではニューモシスチス肺炎についで二番目に多い疾患で、エイズ診断のきっかけとしても重要です。また、深在性真菌症のカンジダ血症は国内で最も頻度の高い侵襲性真菌症で、年間1万例前後の発症と推定されています。
本稿の初版は2019年9月に作成されたものですが、その後C. aurisの知見が集積したことを踏まえ、2023年12月に本稿の内容を改訂しております。
1. 症状
カンジダ属による感染症は大きく分けて表在性カンジダ症と深在性カンジダ症とがある。
表在性カンジダ症の代表的な疾患としては、口腔咽頭カンジダ症 (鷲口瘡)、外陰部腟カンジダ症、カンジダ皮膚炎などが挙げられる。口腔咽頭カンジダ症では、粘膜に白苔が認められ、口腔異常感、味覚異常や疼痛などが自覚される。外陰部腟カンジダ症は無症状例もあるが、有症状例では外陰部掻痒感、白色帯下、排尿痛などが症状として現れる。カンジダ皮膚炎は皮膚の慢性的な浸軟によって生じるカンジダ菌体成分に対する過敏反応によるものであり、限局的な掻痒感または有痛性の紅斑を呈すると報告される1。
一方、深在性カンジダ症はより重篤な病態であり、カンジダ属の深部臓器・組織への侵襲および全身への播種による複数臓器病変を形成する。最も典型的な深在性カンジダ症の表現型はカンジダ属血流感染症 (カンジダ血症) であり、、適切な治療がなされれば播種性病変が顕在化することは少ないが、時に肝臓、脾臓、腎臓、心臓(内膜)、眼, 骨、中枢神経系などへの播種が生じうる重篤な病態である。。カンジダ血症に続発する頻度の高い合併症としてカンジダ眼内炎があり、その合併率は報告により様々であるが、15~25%程度に合併するとされる2, 3。わが国におけるカンジダ眼内炎の疫学研究では、その合併率は19.5% (疑い例含む) と報告される4。
2. 病原体
最も分離頻度の高い原因菌種はCandida albicansであり、ついでCandida glabrata、Candida parapsilosis、Candida tropicalisなどがある5, 6。この4菌種が原因菌種の90%程度を占めると報告されるが、そのほか、Candida krusei、Candida guilliermondii、Candida lusitaniaeなどが原因菌種であるカンジダ症も近年増加傾向にある7。C. glabrataとC. kruseiは、アゾール系薬に低感受性を示す株が多く、治療の際には注意を要する。また、近年では米国などにおいてCandida aurisによる院内アウトブレイク例が相次いで報告されており、ヒト皮膚および環境中への長期間の定着、高率に認められる抗真菌薬耐性株など、他のカンジダ属とは異なる特徴を有していることから、本菌種への注目が世界的に高まっている8, 9。
カンジダ属は、わが国における菌血症の主要な病原体の一つであることが、厚生労働省院内感染対策サーベイランス事業 (Japan Nosocomial Infections Surveillance : JANIS)の成果として示されている。菌血症における分離頻度が高いことに加え、カンジダ血症の致死率が30~50%程度と高いことからは、カンジダ属は黄色ブドウ球菌等と同様、極めて注視すべき血流感染症の原因微生物である。JANISのデータによると、C. albicansは全血液分離菌の2%を占めることが示されているが、C. albicans以外の菌種(non-albicans Candida) が同程度以上の割合で分離されることを考慮すれば、血液培養陽性例の4~5%からカンジダ属が検出されていると推定される10。
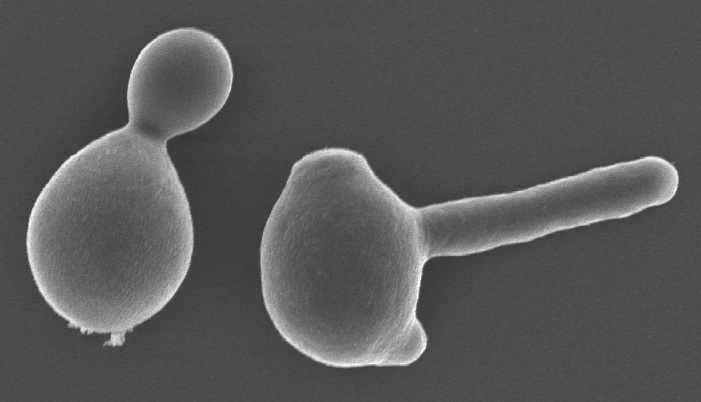 |
| Candida albicans |
3. 検査
カンジダ症の確定診断には、病変部からの培養検査が重要である。特にカンジダ血症の診断においては血液培養が最も重要である。また、カンジダ血症と診断された場合には眼底検査を行い、眼内炎の有無を確認することが推奨される11。顕微鏡検査、病理組織学的検査によって真菌の存在や侵襲の有無は確定できるため、真菌症としての確定診断は可能であるが、菌種同定は形態学的には困難である。また、カンジダ属はヒトの口腔内・腸管などの粘膜および皮膚などに広く常在することも知られており、培養検査で検出された場合でも、検体の種類によっては原因菌と断定できない場合があり注意を要する。補助診断として、非特異的ではあるが血清β-D-グルカン測定が有用である12。しかしながら、β-D-グルカン検査は多くの深在性真菌症で陽性となること、また偽陽性も報告されていることなどから、臨床経過が疾患に適合するかの判断が必要である。
4. 治療
カンジダ血症の治療においては,抗真菌薬の有効性を評価した上での適切な抗真菌薬投与、中心静脈カテーテルの抜去、血液培養陰性化後最低2週間の抗真菌薬継続 (眼内炎合併例はより長期の治療が必要となる) などが重要である11, 13, 14。エキノキャンディン系やアゾール系抗真菌薬が第一選択薬となっているが、原因菌種によって治療薬を使い分ける必要がある。例えばC. glabrataやC. kruseiのようなアゾール耐性あるいは低感受性菌の場合にはエキノキャンディン系抗真菌薬が使用される。一方、眼内炎合併例の場合は、エキノキャンディン系抗真菌薬の有効性は一般的に低いと報告されており、重症度および原因菌種に応じてアゾール系またはポリエン系抗真菌薬での治療が推奨される。
5. Candida aurisについて
C. aurisは2009年に耳漏より分離され、新規のカンジダ属として帝京大学の槇村・山口らにより初めて報告された菌種である15。報告当初は耳漏からの分離株 (非侵襲性株) であったが、その後短期間に複数の国から血流感染症の報告 (侵襲性株) が相次いでなされ現在ではemerging pathogen (新興病原微生物) の一つとして位置付けられるようになった16-20。わが国においてはこれまで非侵襲性の報告しかなかったが、2020年に国内初となるC. auris血流感染症により死亡した症例 (Clade I <South Asian Clade>:フィリピンで集中治療歴を有する患者)が発生し、2023年に報告された21。国内での発生を受け、令和5年5月1日、厚生労働省健康局結核感染症課事務連絡「多剤耐性で重篤な感染症を引き起こす恐れのあるカンジダ・アウリス(Candida auris) について(情報提供及び依頼)」により、C. aurisに関する情報提供を各自治体へ依頼し、国内でのC. auris感染症の発生状況の把握を図っている22。
C. aurisは、1) 抗真菌薬に耐性を示す株の割合が高い、2) 環境中での長期間生存およびヒトへの長期間の定着が示されており、院内 (集中治療室など) で医療機器を介したアウトブレイク事例が複数報告されている、という2点において、現在注視すべき真菌の一つに挙げられている。
抗真菌薬耐性の観点から複数国の分離株の薬剤感受性を調査した研究では、93%の分離株がフルコナゾール耐性、35%がアムホテリシンB耐性、また41%が2種類以上の抗真菌薬に耐性という結果であり、さらには3系統の抗真菌薬すべてに耐性を示す菌株も報告されている17。C. auris感染症に対する治療戦略の確立は重要な課題の一つである。
C. aurisのヒトへの定着は、鼻腔、鼠径部、腋窩、直腸など様々な身体部位に生じ、初回検出時より3ヵ月以上経過しても検出されうると報告される8, 19。ヒトへの定着の危険因子には、C. auris保菌者・その周囲の環境との接触が含まれ、C. auris保菌までに要する時間はわずか数時間とする研究報告もあり、ヒトへの定着は、汚染された環境などから容易に生じうると推察される19, 23。短期間での定着、多剤耐性の可能性および侵襲性感染症発症時の高い致死率を鑑みると、院内におけるC. aurisに対する感染対策が極めて重要となる。欧米のガイドラインでは、患者の隔離 (Isolation)、手指消毒と接触予防策 (Hand hygiene and Contact precautions)、感染患者に使用した備品・環境の清掃・消毒 (Cleaning and Disinfection) の重要性が挙げられている24-27。C. aurisは、人の手を介した直接的な接触感染や、環境表面を介した間接的な接触感染により伝播することから、特に手指衛生が重要と考えられている。また、C. auris感染症患者・保菌者から曝露を受けた可能性がある者に対しては、腋窩・鼠径部のスクリーニング検査が推奨されており、保菌の有無を確認することがアウトブレイク防止に重要と考えられる28, 29。また、
C. aurisは乾燥・湿潤環境のいずれでも長期生存が確認され、また、プラスチック表面でも14日間程度生存しうることが報告されている26, 30, 31。この生存率はC. albicansよりも長期であり、環境汚染がより生じやすいことが示唆される。また、消毒薬に対する抵抗性も高く、クロルヘキシジングルコン酸塩、第四級アンモニウム塩などの低水準消毒薬については、効果は限定的であると報告されている 32, 33。環境表面の消毒においては、エタノール、次亜塩素酸ナトリウムなどの中水準以上の消毒薬が有効と報告されるが、推奨された濃度・接触時間を守ることが重要である24, 32, 33。また、患者・保菌者の退院後に適切に病室の最終清掃・消毒を行うことも重要であり、高濃度次亜塩素酸ナトリウムと蒸気化過酸化水素または紫外線の併用が高い効果を発揮するという報告もある8, 19, 34。保菌した患者周辺の物品の表面や、医療器具 (体温計・血圧計・パルスオキシメーター・聴診器など) の広範な環境汚染も報告されており、使用した医療器具の適切な洗浄と消毒、周辺環境の適切な清掃・消毒を実施することが院内感染対策上重要と考えられる29, 35, 36。
これらの背景を受け、わが国でも「カンジダ・アウリス 診療の手引き」が作成・公開されており、対策が急がれている37。
※ 2024年2月29日追記
国立感染症研究所真菌部では、C. auris特異的なリアルタイムPCR用プライマーを開発している。プライマーの配列は以下の通りである。
| Candida-auris-5Fwd | ACGTATGTCTCATCCCAATTCTCC |
| Candida-auris-5Rev | ATCACGCACCACCCACTCTATTC |
- 山口英世、病原真菌と真菌症 改訂4版、南山堂、東京、2007
- Durand ML. Endophthalmitis. Clin Microbiol Infect. 2013; 19(3): 227-34.DOI
- Oude Lashof AM, Rothova A, Sobel JD, Ruhnke M, Pappas PG, Viscoli C, Schlamm HT, Oborska IT, Rex JH, Kullberg BJ. Ocular manifestations of candidemia. Clin Infect Dis. 2011; 53(3): 262-8.DOI
- Ueda T, Takesue Y, Tokimatsu I, Miyazaki T, Nakada-Motokawa N, Nagao M, Nakajima K, Mikamo H, Yamagishi Y, Kasahara K, Yoshihara S, Ukimura A, Yoshida K, Yoshinaga N, Izumi M, Kakeya H, Yamada K, Kawamura H, Endou K, Yamanaka K, Yoshioka M, Amino K, Ikeuchi H, Uchino M, Miyazaki Y. The incidence of endophthalmitis or macular involvement and the necessity of a routine ophthalmic examination in patients with candidemia. PLoS One. 2019; 14(5): e0216956.DOI
- Pfaller M, Neofytos D, Diekema D, Azie N, Meier-Kriesche HU, Quan SP, Horn D. Epidemiology and outcomes of candidemia in 3648 patients: data from the Prospective Antifungal Therapy (PATH Alliance®) registry, 2004-2008. Diagn Microbiol Infect Dis. 2012; 74:323-31.DOI
- Pfaller MA, Diekema DJ : Epidemiology of invasive candidiasis : a persistent public health problem. Clin Microbiol Rev, 20: 133-163, 2007.DOI
- Pfaller MA, Diekema DJ, Turnidge JD, Castanheira M, Jones RN. Twenty Years of the SENTRY Antifungal Surveillance Program: Results for Candida Species From 1997-2016. Open Forum Infect Dis. 2019; 6(Suppl 1): S79-S94.DOI
- Vallabhaneni S, Kallen A, Tsay S, Chow N, Welsh R, Kerins J, Kemble SK, Pacilli M, Black SR, Landon E, Ridgway J, Palmore TN, Zelzany A, Adams EH, Quinn M, Chaturvedi S, Greenko J, Fernandez R, Southwick K, Furuya EY, Calfee DP, Hamula C, Patel G, Barrett P, Lafaro P, Berkow EL, Moulton-Meissner H, Noble-Wang J, Fagan RP, Jackson BR, Lockhart SR, Litvintseva AP, Chiller TM. Investigation of the First Seven Reported Cases of Candida auris, a Globally Emerging Invasive, Multidrug-Resistant Fungus-United States, May 2013-August 2016. Am J Transplant. 2017; 17(1): 296-299.DOI
- Eyre DW, Sheppard AE, Madder H, Moir I, Moroney R, Quan TP, Griffiths D, George S, Butcher L, Morgan M, Newnham R, Sunderland M, Clarke T, Foster D, Hoffman P, Borman AM, Johnson EM, Moore G, Brown CS, Walker AS, Peto TEA, Crook DW, Jeffery KJM. A Candida auris Outbreak and Its Control in an Intensive Care Setting. N Engl J Med. 2018; 379(14): 1322-1331.DOI
- Kajihara T, Yahara K, Nagi M, Kitamura N, Hirabayashi A, Hosaka Y, Abe M, Miyazaki Y, Sugai M. Distribution, trends, and antifungal susceptibility of Candida species causing candidemia in Japan, 2010-2019: A retrospective observational study based on national surveillance data. Med Mycol. 2022; 60(9): myac071.DOI
- Pappas PG, Kauffman CA, Andes DR, Clancy CJ, Marr KA, Ostrosky-Zeichner L, Reboli AC, Schuster MG, Vazquez JA, Walsh TJ, Zaoutis TE, Sobel JD. Clinical Practice Guideline for the Management of Candidiasis: 2016 Update by the Infectious Diseases Society of America. Clin Infect Dis. 2016; 62(4): e1-50.DOI
- Lamoth F, Akan H, Andes D, Cruciani M, Marchetti O, Ostrosky-Zeichner L, Racil Z, Clancy CJ. Assessment of the Role of 1,3-β-d-Glucan Testing for the Diagnosis of Invasive Fungal Infections in Adults. Clin Infect Dis. 2021; 72(Suppl 2): S102-S108.DOI
- Takesue Y, Ueda T, Mikamo H, Oda S, Takakura S, Kitagawa Y, Kohno S; ACTIONs Project. J Antimicrob Chemother. 2015; 70(2): 587-93.DOI
- 一般社団法人 日本医真菌学会、侵襲性カンジダ症に対するマネジメントのための臨床実践ガイドライン、2021年
- Satoh K, Makimura K, Hasumi Y, et al. Candida auris sp. nov., a novel ascomycetous yeast isolated from the externa ear canal of an inpatient in a Japanese hospital. Microbiol Immunol 2009; 53: 41-4.DOI
- Chowdhary A, Sharma C, Duggal S, et al. New clonal strain of Candida auris, Delhi, India. Emerg Infect Dis 2013; 19: 1670-3.DOI
- Lockhart SR, Etienne KA, Vallabhaneni S, et al. Simultaneous emergence of multidrug resistant Candida auris on 3 continents confirmed by whole-genome sequencing and epidemiological analyses. Clin Infect Dis 2017; 64: 134-40.DOI
- Magobo RE, Corcoran C, Seetharam S, et al. Candida auris-associated candidemia, South Africa. Emerg Infect Dis 2014; 20: 1250-1.DOI
- Schelenz S, Hagen F, Rhodes JL, et al. First hospital outbreak of the globally emerging Candida auris in a European hospital. Antimicrob Resist Infect Control 2016; 5: 35.DOI
- Chowdhary A, Sharma C, Meis JF. Candida auris: a rapidly emerging cause of hospital-acquired multidrug-resistant fungal infections globally. PLoS Pathog 2017; 13: e1006290.DOI
- Ohashi Y, Matono T, Suzuki S, Yoshino S, Alshahni MM, Komori A, Makimura K. The first case of clade I Candida auris candidemia in a patient with COVID-19 in Japan. J Infect Chemother. 2023; 29(7): 713-717.DOI
- 厚生労働省健康局結核感染症課 事務連絡「多剤耐性で重篤な感染症を引き起こす恐れのあるカンジダ・アウリス (Candida auris) について(情報提供及び依頼)」、令和5年5月1日、https://www.mhlw.go.jp/content/10900000/001093562.pdf
- Shackleton J, Schelenz S, Rochon M, Hall A, Ryan L, Cervera-Jackson R. The impact of environmental decontamination in a Candida auris outbreak. J Hosp Infect. 2016; 94(1): S88–9.
- 米国CDC. Infection Prevention and Control for Candida auris. https://www.cdc.gov/fungal/candida-auris/c-auris-infection-control.html. (Accessed on 24th December 2023).
- 英国保健安全庁. Candida auris: laboratory investigation, management and infection prevention and control (draft)https://www.gov.uk/government/consultations/candida-auris-update-to-management-guidance/candida-auris-laboratory-investigation-management-and-infection-prevention-and-control-draft#infection-prevention-and-control. (Accessed on 24th December 2023).
- 欧州CDC. Candida auris in healthcare settings – Europe.
https://www.ecdc.europa.eu/sites/default/files/documents/RRA-Candida-auris-European-Union-countries.pdf (Accessed on 24th December 2023). - Spivak ES, Hanson KE. Candida auris: an Emerging Fungal Pathogen. J Clin Microbiol 2018; 56: 1-10.DOI
- Keighley C, Garnham K, Harch SAJ, Robertson M, Chaw K, Teng JC, Chen SC. Candida auris: Diagnostic Challenges and Emerging Opportunities for the Clinical Microbiology Laboratory. Curr Fungal Infect Rep. 2021; 15(3): 116-126.DOI
- 米国CDC. Screening for Candida auris Colonization. https://www.cdc.gov/fungal/candida-auris/c-auris-screening.html. (Accessed on 24th December 2023).
- Piedrrahita CT, Cadnum JL, Jencson AL, et al. Envrionmental surfaces in healthcare facilities are a potential source for transmission of Candida auris and other Candida species. Infect Control Hosp Epidemiol 2017; 38: 1107-9.DOI
- Welsh RM, Bentz ML, Shams A, et al. Survival, persistence, and isolation of the emerging multidrug-resistant pathogenic yeast Candida auris on a plastic healthcare surface. J Clin Microbiol 2017; 55: 2996-3005.DOI
- Rutala WA, Kanamori H, Gergen MF, Sickbert-Bennett EE, Weber DJ. Susceptibility of Candida auris and Candida albicans to 21 germicides used in healthcare facilities. Infect Control Hosp Epidemiol. 2019; 40(3): 380-382.DOI
- 英国保健安全庁. Candida auris: a review of recent literature.
https://www.gov.uk/government/consultations/candida-auris-update-to-management-guidance/candida-auris-a-review-of-recent-literature#infection-prevention-and-control. (Accessed on 24th December 2023). - Tsay S, Welsh RM, Adams EH, et al. Notes from the field: ongoing transmission of Candida auris in health care facilities - United States, June 2016 - May 2017. MMWR Morb Mortal Wkly Rep 2017; 66: 514-5.DOI
- 欧州CDC. Rapid risk assessment: Candida auris outbreak in healthcare facilities in northern Italy, 2019-2021. https://www.ecdc.europa.eu/en/publications-data/rapid-risk-assessment-candida-auris-outbreak-healthcare-facilities-northern-italy (Accessed on 24th December 2023).
- Pacilli M, Kerins JL, Clegg WJ, Walblay KA, Adil H, Kemble SK, Xydis S, McPherson TD, Lin MY, Hayden MK, Froilan MC, Soda E, Tang AS, Valley A, Forsberg K, Gable P, Moulton-Meissner H, Sexton DJ, Jacobs Slifka KM, Vallabhaneni S, Walters MS, Black SR. Regional Emergence of Candida auris in Chicago and Lessons Learned From Intensive Follow-up at 1 Ventilator-Capable Skilled Nursing Facility. Clin Infect Dis. 2020; 71(11): e718-e725.DOI
- 国立国際医療研究センター 国際感染症センター. 「カンジダ・アウリス 診療の手引き 第1.0版」https://dcc-irs.ncgm.go.jp/topics/candida-auris/ (Accessed on 24th December 2023).