(IDWR 2004年第14号掲載)
A型肝炎はA型肝炎ウイルス(HAV)感染による疾患である。一過性の急性肝炎が主症状であり、治癒後に強い免疫が残さ れる。HAVは糞便中に排泄され、糞口感染で伝播するので、 患者の発生は衛生環境に影響されやすい。A型肝炎は発展途上国では蔓延しているが、先進国では上下水道などの整備により感染者は激減している。しかしなが ら、HAV感染の少ない 状態が長期間継続すると抗体陰性者が増加する。日本では50歳以下での抗体陽性者は極めて少ない。最近の日本のA型肝炎では乳幼児、学童の患者は殆ど見ら れず、患者の高年齢化が 顕著である。また、大規模な集団発生はみられないが、飲食店を介した感染や、海外渡航者 の感染がみられる。ますます盛んになる国際交流、発展途上国からの輸入食料品の増加など、 A型肝炎の感染予防対策は社会的に重要な問題として認識されるようになってきた。国産の不活化ワクチンが製造認可され、1995年から医療現場で使われている。
疫 学
HAVは全世界に分布している。衛生環境が劣悪な地域では乳幼児期の感染が主であり、こうした地域では肝炎発生率が低く、流行もない。上下水道などの整備 により、糞口感染性疾患は発生の様相に大きな変化が生じるが、A型肝炎も例外ではない。まず、都市部を中心に感染率が低下し、感受性者が蓄積されて流行が 認められるようになる。1988年に中国上海市で発生した約30万例の大流行は好例である。生活環境がさらに整備されると大流行の発生が止まる。A型肝炎 の大規模な流行発生は日本では終焉した。
1973、1984、1994年の血清検体で、一般日本人の年齢別抗体保有状況が調べられた。調査 間隔年齢に相当して抗体保有率曲線が高年齢層にシフトしており、日本では過去30年以上の期 間、HAV感染が少ないことが明らかにされた(IASR病原微生物検出情報1997年Vol.18、p10、 特集「A型肝炎」 図4参照)。抗体保有率が非常に低下したために、施設内の集団発生や家族 内感染への注意も必要である。
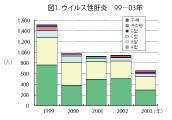
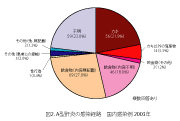
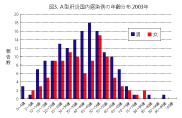
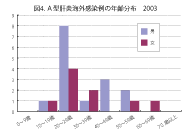
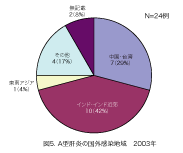
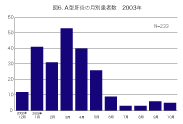
感染症発生動向調査での2003年10月までの集計から、最近の日本のA型肝炎発生状況の特 徴は以下のように集約される。1)年間500人前後の患者報告数がある(図1)。2)主要な感染 源は牡蠣やなんらかの飲食物(おそらく海産物) によるものである(図2)。3)罹患年齢では乳幼 児や学童は稀で、高年齢化が認められる(図3)。 子供の感染では症状が軽くてすむが、高齢者 では重症化しやすいので注意が必要である。4) 患者全体の約1割が海外渡航からの帰国者で あり(図4)、殆ど中国、インド、東南アジア地域 での感染である(図5)。5)A型肝炎の発生には季節変動がある。日本では秋に少なく、冬から春、初夏にかけての発生が多い(図6)。
病原体
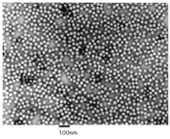
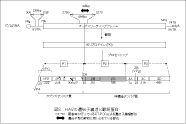
HAVはピコルナウイルス科のへパトウイルス属に所属する。ウイルス粒子は直径27nmの裸の正20面体であり(図7)、ゲノムは5’端末にVPg蛋白、3’端にポリA鎖が結合した約7.5kbのプラス鎖RNAである(図8)。 HAV粒子の構造と性状、ゲノムの構造と機能、粒子形成などは基本的に は他のピコルナウイルスと共通であるが、成熟粒子にVP4が検出されないこと、VP1/2A接合部 が切断されないまま粒子形成が進行するなどの特徴がある。A型肝炎ウイルスは発見当初、ピコルナウイルス科のエンテロウイルス属に分類されていたが、塩基 配列相同性が極めて低いた めに、ヘパトウイルス属として独立した。HAVの遺伝子型は7種類に分けられているが、血清型 は1種類のみである。
 |
 |
|
図7. 精製A型肝炎ウイルス(HAV)の電子顕微鏡像 |
図8. HAVの遺伝子構造と翻訳蛋白 |
HAVは培養細胞において増殖性であるが、培養細胞を用いた患者糞便検体からのウイルス分離には長期間かか る。また、継代培養により培養細胞に馴化した株でも、増殖速度は他のピコルナウイルスに比較して遅く、一般的に細胞障 害効果(CPE)は示さない。特定の細胞にCPEを示す株もあるが、馴化の過程での遺伝子変異によるものである。生物学的に野生株は肝臓に強い親和性を 持っているが、他の肝炎ウイルス同様、ウイルスの増殖により細胞を殺すことはない。肝 炎は宿主免疫反応を介して起きる。
HAVは酸耐性であり、熱、乾燥などにも強い。エーテルなどの脂溶性物質、界面活性剤、蛋白分 解酵素などに耐性であるが、高圧滅菌、UV照射、 ホルマリン処理、塩素剤処理などで失活する。また、高度精製HAVは微量の水銀イオンなどにより失活し、抗原活性も失われる。
臨床症状
HAVは糞口感染で伝播する。潜伏期は2〜6週間であり、発熱、倦怠感などに続いて血清トランスアミナーゼ (ALTまたはGPT、ASTまたはGOT)が上昇する。食思不振、嘔吐などの消化器症状を伴うが、典型的な症例では黄疸、肝腫大、濃色尿、灰白色便など を認める。まれに劇症化して死亡する例を除き、1〜2カ月の経過の後に回復する。トランスアミナーゼの正常化に3〜6カ月を要する例や、正常化後に再上昇 する例もあるが、慢性化せず、予後は良好である。
他の急性ウイルス性肝炎と比較して、A型肝炎の臨床症状での特徴は、発熱、頭痛、筋肉痛、 腹痛など、いわゆる肝炎症状が強いことがあげられる。しかし、臨床症状や肝障害の改善は早い。肝機能検査では、他の急性肝炎の場合よりAST、ALT、 ALP、LDHなどが高い傾向があるが、正常化するまでの期間は最も短い。他の血清検査ではIgMの増加、チモール混濁反応 (TTT値)で判定される膠質反応の上昇が特徴的である。成人では小児に比べ、臨床症状も肝 障害の程度も強い傾向がある。肝外合併症としては、急性腎不全、貧血、心筋障害などが知られている。
病原診断
A型肝炎の診断には血中のIgM-HAV抗体を確認する。固相化抗ヒトIgM抗体に患者血清を 反応させ、さらにHAV抗原、標識HAV抗体を順次反応させる簡便なIgM捕捉キットが市販されている。IgM抗体は発症から約1カ月後にピークに達し、 3〜6カ月後には陰性となる。重症例ほどIgM抗体価は高く、発症6カ月以降にも検出される例がある。また、治癒が遷延化する例では IgM抗体の持続期間も長い。
IgGおよびIgA抗体の測定は、特殊な血清疫学調査以外には使われていない。IgA抗体は感染後1〜2年間、IgG抗体はさらに長期間持続するので、 一般的な血清疫学調査、免疫グロブリン(ISG)やワクチン接種対象者の選択などには、全クラスのHAV抗体を測定する競合抑制 ELISAなどが用いられる。なお、検出されるHAV抗体はウイルス粒子と結合する防御抗体であり、過去の感染またはワクチン免疫を意味する。
細胞培養によるウイルス分離には長期間が必要なため、診断目的には適さない。発症ごく初期の患者糞便中には、ELISAで測定可能な量(1ml当たり108 粒 子以上)のHAVが含まれることもある。ウイルスRNAを検出するRT-PCR法では、微量のHAVの検出が可能である。発症後2週間以内の糞便検体や血 液中のウイルスRNAを抽出し、RT-PCR法でcDNAを増幅して遺伝子 解析を行えば、感染経路の推定などに役立つ。リアルタイムPCR法も診断に適用されている(平成14年8月16日付、食監発第0816001号)。
治療・予防
原則として急性期には入院し、安静臥床とする。入院中は血液検査などで重症化、劇症化、肝外症状の有無を観察して、症状に応じた治療法がとられる。
予防としては、手洗いの励行などの一般的予防法に加え、ISG(抗体価の問題はあるが)やワクチンを用いた積極的予防法が推奨されている。ただし、ISG による予防効果は数カ月以内 である。したがって、ISGは患者家族や、患者と同一施設内でHAV感染の可能性の高い場合 に緊急的に用いるのが適当である。
ワクチンとしては、培養細胞馴化株を精製してホルマリン処理した不活化ワクチンが世界的に使用されている。日本で開発されたワクチンは、アジュバントや チメロサールなどを含まない 凍結乾燥品である。0、2〜4週、24週経過後の3回のスケジュールで皮下または筋肉内接種を 行なえば、抗体獲得率はほぼ100%であり、防御効果は少なくとも数年以上続く。
感染症法における取り扱い(2012年7月更新)
全数報告対象(4類感染症)であり、診断した医師は直ちに最寄りの保健所に届け出なければならない。
届出基準はこちら
(国立感染症研究所ウイルス第二部 米山徹夫)