(IDWR 2007年第9号掲載)
ノロウイルス(Norovirus)は、電子顕微鏡で観察さ れる形態学的分類でSRSV(小型球形ウイルス)、あるいはノーウォーク様ウイルス“Norwalk-like viruses”という属名で呼ばれてきたウイルスである。2002年の夏、国際ウイルス命名委員会によってノロウイルスという正式名称が決定され、世界 で統一されて用いられるようになった。
ノロウイルスはヒトに対して嘔吐、下痢などの急性胃腸炎症状を起こすが、その多くは数日の経過で自然に回復する。季節的には秋口から春先に発症者が多く なる冬型の胃腸炎、食中毒の原因ウイルスとして知られている。ヒトへの感染経路は、主に経口感染(食品、糞口)である。感染者の糞便・吐物およびこれらに 直接または間接的に汚染された物品類、そして食中毒としての食品類(汚染されたカキあるいはその他の二枚貝類の生、あるいは加熱不十分な調理での喫食、感 染者によって汚染された食品の喫食、その他)が感染源の代表的なものとしてあげられる。ヒトからヒトへの感染として、ノロウイルスが飛沫感染、あるいは比 較的狭い空間などでの空気感染によって感染拡大したとの報告もある。この場合の空気感染とは、結核、麻疹、肺ペストのような広範な空気感染(飛沫核感染) ではないところから、埃とともに周辺に散らばるような塵埃感染という語の方が正確ではないかと考えている。
疫 学
わが国のノロウイルスに関する疫学的データは3つある。
(1)食中毒統計(http://www.mhlw.go.jp/topics/syokuchu/index.html) は、医師の届出によって保健所が検査し、厚生労働省にウイルス性食中毒として報告され集計されている。我が国における集団食中毒がほぼ捉えられている。平 成17年の食中毒発生状況によると、ノロウイルスによる食中毒は、事件数では、総事件数1,545件のうち274件(17.7%)、患者数では総患者数 27,019名のうち8,727名(32.3%)となっている。病因物質別にみると、カンピロバクター・ジェジュニ/コリ(645件)に次いで発生件数が 多く、患者数では第1位となっている。表1、2に平成12年から17年のノロウイルスによる集団食中毒の集計結果を示した。
(2)感染症発生動向調査(週報)の中で、冬季の感染性胃腸炎関連ウイルスとして集計されている。感染性胃腸炎は感染症法の5類感染症定点把握疾患で、全国約3,000カ所の小児科定点医療機関から報告される(https://idsc.niid.go.jp/idwr/index.html)。感染性胃腸炎の報告にあたって原因病原体の特定は求められていないので、すべてが同一の病原体によるものとは断定できないが、同一症状を呈する疾患の動向は把握できる。
(3)病原微生物検出情報(月報)には、地方衛生研究所で検査され、ノロウイルスであることが確認されたものが集計されている(https://idsc.niid.go.jp/iasr/index-j.html)。散発例およびウイルスに起因する集団発生からのノロウイルス検出が捉えられている。
これらのデータはいずれも、日本ではノロウイルス感染症が12月から3月をピークにして全国的に流行していることを示している。
表1. ノロウイルスによる食中毒の年別報告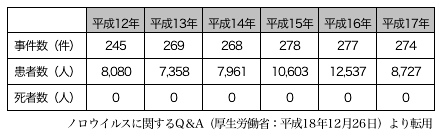
表2. ノロウイルスによる食中毒の年別・月別報告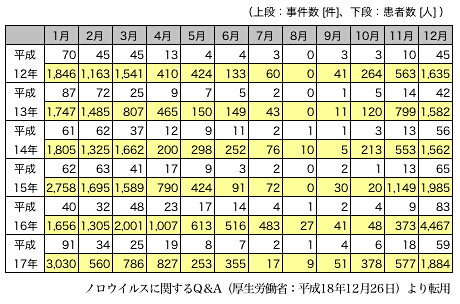
病原体
 |
ノロウイルスはサポウイルス〔Sapovirus;旧名称サッポロ様ウイルス(Sapporo-like viruses : SLV)〕と並ぶカリシ(ラテン語:コップを意味する)ウイルス科の属名である。 |
|
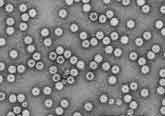
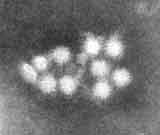
図1. ノロウイルスの電子顕微鏡像(埼玉県衛生研究所篠原先生撮影) |
ウイルス粒子を電子顕微鏡で見たときに、その表面にコップ状の窪んだ構造が観察されることがカリシウイルス命名の由来となっている。図1に ノロウイルスの電子顕微鏡像を示した。直径が38ナノメータの正二十面体である。プロトタイプは1968年に米国オハイオ州ノーウォークの小学校で発生し た集団胃腸炎から検出され、1972年に免疫電子顕微鏡下でその形態が明らかになったノーウォークウイルス/68(NV/68)である。以来、形態学的に NV/68と区別できないが抗原的に異なる株は、発見された地名を冠して、たとえばスノーマウンテンウイルス、メキシコウイルス、わが国でも音更(おとふ け)因子、チバウイルスなどと命名されてきた。ノロウイルスは培養細胞や実験動物への感染がいまだに成功していないウイルスで、ヒトが唯一の感受性動物で あるといってよい。現在、ノロウイルスに属するウイルスはGenogroup I (GI)とGenogroup II (GII)の2つの遺伝子群に分類され、さらにそれぞれは14と17あるいはそれ以上の遺伝子型(genotype)に分類される。また、各遺伝子型に対応 した血清型があると考えられ、極めて多様性を持った集団として存在する。図2に構造蛋白コード領域の上流部分約250塩基の塩基配列に基づいて作成した系 統樹を示した。この領域は、後述するノロウイルス検出用RT-PCRプライマーG1SKF & G1SKR, G2SKF & G2SKRによって増幅されるPCR増幅産物の、プライマー部分を除いた領域である。GI, GIIに含まれる遺伝子型番号は欧米の研究者らと協議の上、Fields VIROLOGYの第4版に従ってナンバリングした。「病原微生物検出情報 Vol.24 No.12, p.5」に掲載済みの系統樹と番号が異なる遺伝子型があるが、今後の混乱を防ぐ意味でも、今後は本報のナンバリングに従っていただきたい。その方が、海外 の研究者との情報交換もスムーズにいくと思われる。
| 図2. ノロウイルスの構造蛋白全領域に基づく系統樹 | |
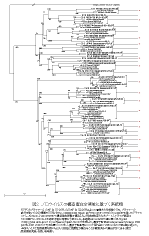 |
RT-PCRプライマーG1SKF & G1SKR, G2SKF & G2SKRによって増幅される領域のうち、プライマーの部分を除いた253塩基をDDBJ(http://www.ddbj.nig.ac.jp /Welcome-j.html)のclustalWを用いてアライメントし、Kimura 2-parameterで遺伝学的距離を算出した。分岐点検定のためブートストラップ検定は1000回行い、950以上を統計学的に有意な分岐とした。系 統樹はclustalWの値に基づき、Njplot(http://pbil.univlyon1.fr/software/njplot.html)で 作成した。遺伝子型別はKatayamaら(Viology 299, p225-239, 2002)の方法に基づいて行い、遺伝子型番号についてはFields VIROLOGYの第4版に従った。*印は、VLPと免疫血清を用いたEIAで、相互に抗原性が異なることを確認済みの遺伝子型である(国立感染症研究 所、名取)。 |
臨床症状
ノロウイルスのボランティアへの投与試験の結果から、潜伏期は1〜2日であると考えられている。嘔気、嘔吐、下痢が主症状で あるが、腹痛、頭痛、発熱、悪寒、筋痛、咽頭痛、倦怠感などを伴うこともある。特別な治療を必要とせずに軽快するが、乳幼児や高齢者およびその他、体力の 弱っている者での嘔吐、下痢による脱水や窒息には注意をする必要がある。ウイルスは、症状が消失した後も3〜7日間ほど患者の便中に排出されるため、2次 感染に注意が必要である。ボランティアのバイオプシー由来の腸管組織を病理組織学的に観察した結果から、ノロウイルスはヒトの空腸の上皮細胞に感染して繊 毛の委縮と扁平化、さらに剥離と脱落を引き起こして下痢を生じると考えられている。しかしながら、このような現象がどのようなメカニズムによるものなの か、その詳細はまだ不明である。
病原診断
ノロウイルスの検出はあくまでも電子顕微鏡による観察が基本であるが、対象が患者糞便に限られるのが難点である。現在に至ってもウイルスの培養が出来ず、本法がノロウイルス検出の基本であるが、この方法で検出するには106個/ml以上のウイルス粒子が必要であるので、感度は低い。また、形態学的にノロウイルスが観察できても、ノロウイルスであることを同定できるわけではない。
前述した様にノロウイルスは、培養細胞で再現性良く増殖させることができない。これがネックとなり、ノロウイルスに関する基礎的な研究は遅れていた。し かし、ここ数年で20株を超えるノロウイルスのゲノム全塩基配列が決定され、ウイルスゲノムが詳細に解析されたことにより、新たな診断法が開発された。一 つは、ゲノムの中で最も高度に保存された領域を標的としたリアルタイムRT-PCRシステムの構築である(図3)。この方法により、ノロウイルスゲノムを超高感度に定量測定することが可能となった。
もう一つは、ウイルス様粒子(VLP)を用いた抗原検出システムの構築である。ノロウイルスゲノムの構造蛋白質領域をバキュロウイルスに組み込み、昆虫細胞で発現させると、ウイルス粒子と酷似したVLPを作出できることが明らかにされた(図4)。 VLPは構造がノロウイルスそのものであり、ウイルス粒子と同等の抗原性を有するが、内部にゲノムRNAを持たず、中空で感染性はない。現在、互いに抗原 性の異なると予想されるノロウイルスは30種類以上になろうとしているが、その約60%をカバーするVLPの作出に成功している。これらのVLPをウサギ に免疫して得たポリクローナル抗体を用いて構築したEIAキットが、前述の抗原検出システムである。このキットにより、特殊な機器を必要としない迅速かつ 簡便な抗原検出が可能となった。しかし、ノロウイルスの新しい遺伝子型が現在もなお発見され続けており、これらに対応するためには、新たなVLPの作出と 抗体の作製を継続しなければならない。
治療・予防
感染者より排泄された糞便および吐物は、感染性のあるものとして注意が必要である。下水より汚水処理場に至ったウイルスの一部は浄化処理をかいくぐり、 河川に排出され、海でカキなどの二枚貝類の中で濃縮される。汚染されたこれらの貝類を生のまま、あるいは十分加熱しないまま食べると、再びウイルスは人体 に戻り、感染を繰り返す。一般に、加熱した食品であればウイルスは完全に失活するので問題はないが、サラダなど加熱調理しないで食する食材が感染源とな る。例えば、汚染された貝類を調理した手や包丁・まな板などから、生食用の食材に汚染が広がる可能性がある。また最近の報告では、ノロウイルスの感染者を 看護や世話をする機会に、患者の吐物、便などから直接感染するヒト‐ヒト間の感染があることも明らかにされている。
糞口感染するウイルスであるので、食品衛生上の対策としては、食品の取り扱いに際して入念な手洗いなど衛生管理を徹底すること、食品取扱者には啓発、教育を十分に行う事が大切である。
身近な感染防止策として手洗いの励行は重要である。また吐物など、ウイルスを含む汚染物の処理にも注意が必要である。粒子は胃液の酸度(pH 3)や飲料水に含まれる程度の低レベルの塩素には抵抗性を示す。また温度に対しては、60℃程度の熱には抵抗性を示す。したがってウイルス粒子の感染性を 奪うには、次亜塩素酸ナトリウムなどで消毒するか、85℃以上で少なくとも1分以上加熱する必要があるとされている。
治療としてはノロウイルスの増殖を抑える薬剤はなく、整腸剤や痛み止めなどの対症療法のみである。
ノロウイルスに関するQ&A(厚生労働省:平成18年12月26日:http://www.mhlw.go.jp/topics/syokuchu/kanren/yobou/040204-1.html)、国立感染研究所感染症情報センターホームページ「ノロウイルス感染症」(https://idsc.niid.go.jp/disease/norovirus/index.html)に詳細が記されている。
感染症法における取り扱い(2012年7月更新)
「感染性胃腸炎」は定点報告対象(5類感染症)であり、指定届出機関(全国約3,000カ所の小児科定点医療機関)は週毎に保健所に届け出なければならない。
届出基準はこちら
食品衛生法での取り扱い
食中毒が疑われる場合は、24時間以内に最寄りの保健所に届け出る。
(国立感染症研究所ウイルス第二部 片山和彦、
同感染症情報センター)