(2017年6月7日改訂)
麻疹は麻疹ウイルス(Paramyxovirus科Morbillivirus属)によって引き起こされる感染症であり、空気感染(飛沫核感染)、飛沫感染、接触感染と様々な感染経路を示し、その感染力は極めて強い。麻疹に対して免疫を持たない者が感染した場合、典型的な臨床経過としては10~12日間の潜伏期を経て発症し、カタル期(2~4日間)、発疹期(3~5日間)、回復期へと至る。ヒトの体内に入った麻疹ウイルスは、免疫を担う全身のリンパ組織を中心に増殖し、一過性に強い免疫機能抑制状態を生じるため、麻疹ウイルスそのものによるものだけでなく、合併した別の細菌やウイルス等による感染症が重症化する可能性もある。麻疹肺炎は比較的多い合併症で麻疹脳炎とともに二大死亡原因といわれている。さらに罹患後平均7年の期間を経て発症する亜急性硬化性全脳炎(subacute sclerosing panencephalitis: SSPE)などの重篤な合併症もある。先進国であっても麻疹患者約1,000人に1人の割合で死亡する可能性がある。わが国においても2000年前後の流行では年間約20~30人が死亡していた。世界での2015年の5歳以下の小児の死亡数推計によれば、麻疹による死亡は全体の1.2%を占めている (1)。唯一の有効な予防法はワクチンの接種によって麻疹に対する免疫を獲得することであり、2回のワクチン接種により、麻疹の発症のリスクを最小限に抑えることが期待できる。
感染症法に基づく発生動向調査の変遷
わが国における麻疹の流行状況の把握は、1981年7月に当時の厚生省実施の事業により麻しん様疾患の定点把握調査として開始された。1999年4月からは「感染症の予防及び感染症の患者に対する医療に関する法律(以下、感染症法)」が施行されたことに伴い、麻しん及び成人麻しんとして、感染症法に基づく発生動向調査での定点報告疾患となった。定期予防接種率の上昇と、1歳になったらすぐの接種勧奨によって麻疹の患者数は着実に減少し、2006年には過去最低の定点当たり累積報告数となっていたが、2007年に10代、20代を中心とする流行が起こり、多数の高等学校や大学が休校措置を行うなどの社会的問題が生じた。また、世界保健機関(WHO)では、日本を含む西太平洋地域において2012年までに麻疹を排除するという目標を掲げ、わが国においてもこの目標に向け、2007年12月28日、「麻しんに関する特定感染症予防指針(以下、指針)」が施行された。これにより、予防接種については、追加接種の実施による2回接種の徹底が図られるとともに(予防接種率の情報は「麻しん予防接種情報https://www.niid.go.jp/niid/ja/measles-vac.html」参照、抗体保有状況等の情報は「感染症流行予測調査https://www.niid.go.jp/niid/ja/yosoku-index.html」参照)、発生状況の把握については、より正確な把握のため、2008年1月1日より五類感染症の全数報告疾患へ変更された。これにより、医師は麻疹と診断した全ての患者について7日以内の届出が求められるようになった。2012年10月には厚生科学審議会感染症分科会感染症部会麻しんに関する小委員会(委員長・岡部信彦)により同指針の改正案が報告され、厚生労働省における審議・承認を経て、2013年4月1日から新たな指針が告示された。この指針では、医師による麻しんの届出に当たっては、原則として診断後24時間以内の臨床診断としての届出と同時に、医療機関における血清IgM 抗体検査等の血清抗体価の測定の実施および地方衛生研究所におけるウイルス遺伝子検査等の検体の提出を求めることとなった。臨床症状と検査結果を総合的に勘案した結果として、麻しんと判断された場合は麻しん(検査診断例)への届出の変更を求め、麻しんでないと判断された場合は届出の取り下げを求めることとしている。また、原則として全例に対して、地方衛生研究所または国立感染症研究所において、遺伝子配列の解析を行うよう明記している。 さらに2014年の感染症法改正によって、2015年5月21日から、麻しんを診断した医師は直ちに患者氏名、生年月日、住所等の厚生労働省令で定める事項を最寄りの保健所に届け出ることが求められている。
発生動向調査に基づく疫学(2015年以降の報告数は暫定値)
2008年には11,013例が麻しんとして報告されたが、2009年には2008年に比較し93%の減少となる732例となった。その後も減少傾向は継続し、2010年447例、2011年439例、2012年283例、2013年229例であった。2014年には462例と増加したが、フィリピン等のアジア諸国からの輸入例の増加によるものであった。患者の年齢層の中心は、2008年は0~1歳と10代~30代、2009年~2011年は0~1歳、2012年以降は2014年を除き20歳以上の成人が中心となっている。日本における土着の麻疹ウイルス株であった遺伝子型D5の麻疹ウイルスは2010年5月を最後に国内での検出はなくなった。
このような発生状況と、「適切なサーベイランスの制度の下、土着株による麻疹の感染が三年間確認されないこと、又は遺伝子型の解析によりそのことが示唆されること」と言う排除達成の認定基準を満たしたため、、2015年3月27日、WHO西太平洋地域事務局は、日本が麻疹の排除状態にあると認定した。2015年の年間報告数は、2008年以降最低となる35例であったが、2016年は、輸入例を発端とする麻疹の集団発生が複数の自治体で発生したこともあり、報告数は159例となった。なお、2008年以降の詳しい疫学情報については、当センターホームページの麻疹のサイトで公表している「発生動向」https://www.niid.go.jp/niid/ja/hassei/575-03.htmlの記事を適宜参照していただきたい。
病原体
原因ウイルスである麻疹ウイルスは パラミクソウイルス科(Paramyxoviridae)、モリビリウイルス属(Morbillivirus)に属する (-)鎖の一本鎖RNAゲノムを持つウイルスである。宿主細胞に由来する脂質二重膜のエンベロープを持ち、N、P、M、F、H、Lの6つの構造蛋白質により構成されている。糖蛋白質であるH蛋白質とF蛋白質はエンベロープからスパイク状に突出し、抗原性に関与している。麻疹ウイルスの血清型は単一であり、1960-70年代に開発されたワクチン株は現在の流行株に対しても有効な抗体を誘導できる。自然宿主はヒトのみである。
麻疹ウイルスはN遺伝子の定められた一部の配列(450塩基)、または全H蛋白質翻訳領域の遺伝子配列(1854塩基)を系統樹解析することで、8 clade、24遺伝子型に分類される(2)。現在使用されているワクチン株は全て遺伝子型Aに属している。
麻疹ウイルスの宿主側の受容体として、CD46(membrane cofactor protein:MCP), SLAM(signaling lymphocyte activation molecule;CD150), Nectin-4の3つの分子が同定されている(3-6)。免疫細胞に発現しているSLAM は、主に麻疹ウイルスが宿主に感染する時に利用され、また、免疫細胞で増殖したウイルスが上皮細胞に感染し、気道腔内等へ放出される時には極性上皮細胞の細胞間隙に発現している Nectin-4が利用されると考えられている(7)。CD46分子は、ウイルスの細胞結合能を担うH蛋白質に特定の変異を持つワクチン株や一部の実験室株は利用できるが、野生株は利用できないことが知られている(7)。構造解析等により、H蛋白質と受容体の結合領域が、H蛋白質の主要な中和エピトープとなっていることが報告されており、麻疹ウイルスの血清型が単一であることの理由の一つと考えられている (9,10)。
麻疹ウイルスは熱、紫外線、酸、エーテル等で容易に不活化され、空気中や物体表面での生存時間は短い。
臨床症状 (11-23)
1.麻疹
麻疹ウイルスに対する免疫を持たない者が麻疹ウイルスに感染した場合には、以下のような経過で臨床症状を呈する。
|
|
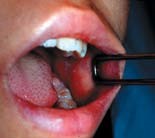
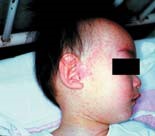
| 写真1. 口腔内にみられるコプリック斑 | 写真2. 顔面にみられる発疹 |
<前駆期(カタル期)>
感染後に潜伏期10~12日を経て発症する。38 ℃前後の発熱が2~4日間続き、倦怠感があり、小児では不機嫌となり、上気道炎症状(咳嗽、鼻漏、咽頭痛)と結膜炎症状(結膜充血、眼脂、羞明)が現れ、次第に増強する。
乳幼児では8~30%に消化器症状として下痢、腹痛を伴う(11,12)。発疹出現の1~2 日前頃に頬粘膜の臼歯対面に、やや隆起し紅暈に囲まれた約1mm 径の白色小斑点(コプリック斑)(写真1)が出現する。コプリック斑は診断的価値があるが届出基準には含まれない。発疹出現後2日目の終わりまでに急速に消失する。また、口腔粘膜は発赤し、口蓋部には粘膜疹がみられ、しばしば溢血斑を伴うこともある。
<発疹期>
カタル期での発熱が1℃程度下降した後、半日くらいのうちに再び高熱(多くは39.5 ℃以上)が出るとともに(2峰性発熱)、特有の発疹(写真2)が耳後部、頚部、前額部より出現し、翌日には顔面、体幹部、上腕におよび、2日後には四肢末端にまでおよぶ。発疹が全身に広がるまで、発熱(39.5℃以上)が3~4日間続く。発疹ははじめ鮮紅色扁平であるが、まもなく皮膚面より隆起し、融合して不整形斑状(斑丘疹)となる。指圧によって退色し、一部には健常皮膚面を残す。発疹は次いで暗赤色となり、出現順序に従って退色する。発疹期にはカタル症状は一層強くなり、特有の麻疹様顔貌を呈する。
<回復期>
発疹出現後3~4日間続いた発熱も回復期に入ると解熱し、全身状態、活力が改善してくる。発疹は退色し、色素沈着がしばらく残り、僅かの糠様落屑がある。カタル症状も次第に軽快する。
合併症のないかぎり7~10日後には回復する。患者の気道からのウイルス分離は、前駆期(カタル期)の発熱時に始まり、第5~6発疹日以後(発疹の色素沈着以後)は検出されない。この間に感染力をもつことになるが、カタル期が最も強い。
<合併症>
1) 肺炎:麻疹の二大死因は肺炎と脳炎であり、注意を要する。肺炎の合併は6%(11)に認められ、乳児では死亡例の60%は肺炎に起因するものである(13)。
| ウイルス性肺炎 | 病初期に認められ、胸部X 線上、両肺野の過膨張、瀰漫性の浸潤影が認められる。また、片側性の大葉性肺炎の像を呈する場合もある。 |
| 細菌性肺炎 | 発疹期を過ぎても解熱しない場合に考慮すべきである。原因菌に応じて適切な抗菌薬により治療する。原因菌としては、一般的な呼吸器感染症起炎菌である肺炎球菌、インフルエンザ菌、化膿レンサ球菌、黄色ブドウ球菌などが多い。 |
| 巨細胞性肺炎 | 成人の一部、あるいは特に細胞性免疫不全状態時にみられる肺炎である。肺で 麻疹ウイルスが持続感染した結果生じるもので、予後不良であり、死亡例も多い。発疹は出現しないことが多い。本症では麻疹抗体は産生されず、長期間にわたってウイルスが排泄される。発症は急性または亜急性である。胸部レントゲン像では、肺門部から末梢へ広がる線状陰影がみられる。 |
2) 中枢神経系合併症:1,000例に0.5~1例の割合で脳炎を合併し、思春期以降の麻疹による死因としては肺炎よりも多い。発疹出現後2~6日頃に発症することが多く、髄液所見としては、単核球優位 の中等度細胞増多を認め、蛋白レベルの中等度上昇、糖レベルは正常かやや増加する。麻疹の重症度と脳炎発症には相関はない。患者の約60%は完全に回復するが、25%に中枢神経系の後遺症(精神発達遅滞、痙攣、行動異常、神経聾、片麻痺、対麻痺)を残し、致命率は約15%である。
3) 中耳炎:麻疹患者の約7%(11,12)にみられる最も多い合併症の一つである。細菌の二次感染により生じる。乳幼児では症状を訴えないため、中耳からの膿性耳漏で発見されることがあり注意が必要である。乳様突起炎を合併することがある。
4) クループ症候群:喉頭炎および喉頭気管支炎は合併症として多い。麻疹ウイルスによる炎症と細菌の二次感染による。吸気性呼吸困難が強い場合には、気管内挿管による呼吸管理を要する。
5) 心筋炎:心筋炎、心外膜炎をときに合併することがある。麻疹の経過中半数以上に、一過性の非特異的な心電図異常が見られるとされるが、重大な結果になることは稀である。
6) 亜急性硬化性全脳炎(subacute sclerosing panencephalitis :SSPE):麻疹罹患後の重篤な合併症の一つとして、亜急性硬化性全脳炎がある。麻疹ウイルスの中枢神経への持続感染が原因であり、長い潜伏期間の後に進行性の中枢神経症状を発症し、最終的な予後は非常に悪い。SSPE発症のリスクとして知られているのは、2歳未満での麻疹罹患である。潜伏期間は4~8年とされており、6~10歳頃に発症することが多いとされるが、それ以外の年齢で発症する場合もある。知能障害、運動障害が徐々に進行し、ミオクローヌスなどの錐体・錐体外路症状を示すが、特に成人発症例では、非典型的な経過をとることが多く、若年発症の進行性の認知機能障害などが認められた場合ではSSPEも鑑別する必要がある(14,15)。SSPEは男性の方が女性よりも2~3倍多いことが知られている。麻疹ワクチン導入前における麻疹患者10万人あたりのSSPE発症は、米国では1人、発展途上国では20~100人とされていた(16)。しかし、最近のドイツ、米国からの報告では、5歳未満の麻疹患者のうち、1,300~3,300人に1人がSSPEを発症したと推計されており、従来考えられていた発症率よりも多い可能性が報告されている(17,18)。なお、ワクチン株によるSSPEの発症は、疫学的にもウイルス学的にも認められていない(19,20)。
2.修飾麻疹
修飾麻疹は、上述したような典型的な麻疹の症状を示さず軽症で、感染力も麻疹と比較すると弱い(21,22)。麻疹ウイルスに対する免疫が不十分な場合、例えば母体からの移行抗体をもつ乳児、麻疹含有ワクチンによって誘導された免疫が不十分な場合、麻疹ウイルスに曝露された後に人免疫グロブリンを投与された場合などには、修飾麻疹となり、潜伏期間も14日以上になることがある(13)。症状は、微熱、発熱期間が短い、カタル症状を認めない、限局性の発疹などである(23)。修飾麻疹は、症状のみから診断することは困難であり、検査診断が必要である。ワクチン接種歴や渡航歴はもちろんのこと、麻疹患者との接触歴や職場や学校での患者発生の有無の確認がより重要となる。
病原診断
ウイルス遺伝子の検出、ウイルス分離、麻疹特異的IgM抗体価の上昇、急性期と回復期のペア血清での麻疹IgG抗体の陽転、あるいは有意な上昇をもって診断可能である。近年、修飾麻疹の増加等により診断が困難な患者の割合が増加していることから病原体検出検査(ウイルス遺伝子の検出等)と免疫学的検査(IgM抗体、IgG抗体検査等)の併用が望まれる。2013年改訂の指針では、原則として全例に対してIgM抗体測定とPCR法によるウイルス遺伝子検出の実施を求めている。また、ウイルス遺伝子型情報、遺伝子配列情報は、流行ウイルス株の解析や疫学的リンクの確認、公衆衛生学的に排除状態の維持の確認等に求められており、その意味からもPCR法によるウイルス遺伝子検出、解析は重要である。ウイルス分離は可能な限り実施する。なお、診断に資する検査結果を得るためには、それぞれの検査に適した検体を、適切な時期に採取する事が重要である。麻疹の検査診断に必要な検体や、適切な検体採取時期、検査結果の判断に関しては、「2016年改訂:最近の知見に基づく麻疹の検査診断の考え方https://www.niid.go.jp/niid/images/idsc/disease/measles/pdf01/arugorizumu2016.pdf」もしくは「医療機関での麻疹対応ガイドライン(現在更新中)、https://www.niid.go.jp/niid/ja/diseases/ma/measles/221-infectious-diseases/disease-based/ma/measles/555-measles-guidlines.html」を、実際の実験室診断の手順については「病原体検出マニュアル(第3.4版)https://www.niid.go.jp/niid/images/lab-manual/measles.v3-4.2017Mar.pdf」をそれぞれ参照して頂きたい。
治療・予防
発症すると特異的な治療法はなく対症療法が中心となるが、中耳炎、肺炎など細菌性の合併症を起こした場合には抗菌薬の投与が必要となる。麻疹は空気感染するため、手洗いやマスクでは予防ができない。そのため、ワクチンによる予防が最も重要である。ワクチン接種後2週間後から麻疹特異的な血中抗体が出現するが、麻疹患者と接触後、緊急(72時間以内)に麻疹含有ワクチンの接種を受けることで、発症を予防できる可能性がある。
母体由来の麻疹特異的IgG抗体があると、接種した麻疹ワクチンウイルスの増殖が十分でないため、母体由来の抗体がほぼ消失したと考えられる生後1歳以降の児に接種を行う国が多い。我が国における現行の予防接種法では、1歳児(第1期)と小学校入学前一年間の幼児(第2期)を対象として麻疹風疹混合ワクチン(MRワクチン)による2回接種法が定期接種に導入されているが、MRワクチン接種は、疾患に罹患した場合の重症度、感染力の強さから考え、第1期の接種年齢に達した後なるべく速やかに、少なくとも生後12~15カ月に接種することが望ましい。生後6か月以降は母親由来の免疫が減弱するため、麻疹流行国に渡航する場合や通園している保育所などで患者が発生した場合は、緊急避難的に1歳以前にワクチンを接種する選択もあるが、この場合の接種は定期接種ではなく、任意接種として有料で実施することになる。いずれにしても、1歳前に接種を受けた場合は、1歳以降に更に2回接種(この場合は定期接種として実施)をする必要がある。その理由は、乳児期後期まで母親からの移行抗体が持続している場合があり、その場合はワクチンウイルスが母親の免疫で中和されてしまうため、十分な抗体が産生されない可能性があるためである。また、輸血あるいは人免疫グロブリン製剤を投与された後は、母親からの移行抗体を保有する6カ月未満の乳児と同様の理由で効果が得られないため、通常、3カ月間は接種を行わない。川崎病などの治療で大量療法(200mg/kg以上)を受けた場合には、6カ月間あける必要がある。
ワクチン1回接種による免疫獲得率は93~95%以上、2回接種による免疫獲得率は97~99%以上と報告されており(11,24)、有効性は明らかである。初回接種後の反応としては発熱が約20~30%、発疹は約10%に認められる。いずれも軽症であり、ほとんどは自然に消失する。熱性けいれん既往者に対しては、発熱性疾患罹患時と同様の方法で発熱時の対応について接種前に説明をしておく必要がある。また、接種後30分は血管迷走神経反射による失神やアナフィラキシーに注意が必要である。女性については、接種後2か月間は妊娠を避ける必要がある。
ワクチンアレルギーの原因となったゼラチンに関しては、現行の国産MRワクチンには含まれていない。ごく稀に(100~150 万接種に1例程度)脳炎・脳症が報告されているが、麻疹に罹患したときの脳炎の発症率に比べると遙かに低い。
感染症法における取扱い
「麻しん」は全数報告対象疾患(五類感染症)である。前述したように原則として、医師は臨床診断後直ちに最寄りの保健所への届出と同時に、医療機関における血清IgM 抗体検査等の血清抗体価の測定の実施および地方衛生研究所におけるウイルス遺伝子検査等の検体の提出を求められている。
・届出基準
http://www.mhlw.go.jp/bunya/kenkou/kekkaku-kansenshou11/01-05-14-03.html(麻しん)
・医師による麻しん届出ガイドライン(現在更新中)
学校保健安全法における取り扱い
麻しんは第2種の学校感染症に定められており、解熱した後3日を経過するまで出席停止とされている。ただし、病状により学校医その他の医師において感染の恐れがないと認めたときは、この限りでない。また、以下の場合も出席停止期間となる。
・患者のある家に居住する者又はかかっている疑いがある者、かかるおそれがある者については、予防処置の施行その他の事情により学校医その他の医師において感染のおそれがないと認めるまで。
・発生した地域から通学する者については、その発生状況により必要と認めたとき、学校医の意見を聞いて適当と認める期間
・流行地を旅行した者については、その状況により必要と認めたとき、学校医の意見を聞いて適当と認める期間
【文 献】
- Li L, Oza S, Hogan D, et al.Global, regional, and national causes of under-5 mortality in 2000–15: an updated systematic analysis with implications for the Sustainable Development Goals.Lancet 2016; 388: 3027–35.
- World Health Organization. Measles virus nomenclature update. Wkly Epidemiol Rec 2012;87: 73-80.
- Dorig RE,Marcil A,Chopra A ,et al. The human CD46 molecule is a receptor for measles virus (Edmonston strain). Cell 1993;75:295‐305.
- Tasuo H, Ono N,Tanaka K, et al.:SLAM (CDw 150)is a cellular receptor for measles virus. Nature 2000;406:893-897.
- Noyce RS, Bondre DG, Ha MN, et al. Tumor cell marker PVPL(nectin 4) is an epithelial cell receptor for measles virus. PLoS Pahog 2011; 7.e1002240. doi:10.1371/journal.ppat.1002240.
- Muehlebach MD, Mateo M, Sinn PL, et al. Adherens junction protein nection-4 is the epithelial receptor for measles virus. Nature 2011;480: 530-33.
- Takeda M, Tahara M, Nagata N, et al. Wild-type measles virus is intrinsically dual-tropic. Front Microbiol 2; 279:2012.
- Erlenhoefer C, Duprex WP, Rima B, et al.Analysis of receptor(CD46, CD150) usage by measles virus.J.Gen.Virol 2002; 83:1431-36.
- Tahara M, Ito Y, Melinda AB, et al. Functional and structural characterization of neutralizing epitopes of measles virus hemagglutinin protein. J. Virol 2013;87:666-75.
- Tahara M, Ohno S, Sakai K, et al. The receptor-binding site of the measles virus hemagglutinin protein itself constitutes a conserved neutralizing epitope. J. Virol 2013;87:3583-6.
- US CDC. Epidemiology and Prevention of Vaccine-Preventable Diseases. Chapter 13 Measels. 13th Ed. 2015. Available at https://www.cdc.gov/vaccines/pubs/pinkbook/meas.html
- American Academy of Pediatrics. Measles In: Red bookR Section 3: Summaries of Infectious Diseases;2015. p535-547
- Anne AG. Measles Virus(Rubeola). In: John EB, Raphael D, Martin JB, editors. Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases. 8th ed. Pennsylvania, Saunders; 2014. p.1967-73
- Studart NA, Nóbrega PR, Duarte MI, et al. Adult-onset subacute sclerosing panencephalitis manifesting as slowly progressive dementia. J Neurovirol. 2015; 21: 468-71.
- Martins R, Peres J, Casimiro C, et al. Subacute sclerosing panencephalitis presenting as rapidly progressive dementia in a young adult. Neurologia. 2017 Mar 16. pii: S0213-4853(17)30032-4.
- Maldonado YA. Rubeola Virus (Measles and Subacute Sclerosing Panencephallitis). In; Long SS, et al (eds); Priciples and Practice of Pediatric Infectious Diseases, 4th ed, Churchill Livingstone, 2012; 1137-1144.
- Schönberger K, Ludwig MS, Wildner M et al. Epidemiology of subacute sclerosing panencephalitis (SSPE) in Germany from 2003 to 2009: a risk estimation. PLoS One. 2013;8:e68909.
- Wendorf KA, Winter K, Zipprich J et al. Subacute Sclerosing Panencephalitis: the Devastating Measles Complication that Might be More Common than Previously Estimated: a risk estimation. Clin Infect Dis. 2017. doi: 10.1093/cid/cix302
- Bellini WJ, Rota JS, Lowe LE et al. Subacute sclerosing panencephalitis: more cases of this fatal disease are prevented by measles immunization than was previously recognized. J Infect Dis. 2005 Nov 15;192:1686-93.
- Campbell H, Andrews N, Brown KE, et al. Review of the effect of measles vaccination on the epidemiology of SSPE. Int J Epidemiol. 2007; 36: 1334-48.
- Rota JS, Hickman CJ, Sowers SB, et al., Two Case Studies of Modified Measles in Vaccinated Physicians Exposed to Primary Measles Cases: High Risk of Infection But Low Risk of Transmission. J Infect Dis 2011; 204 (suppl_1): S559-S563. doi: 10.1093/infdis/jir098
- Rosen JB,Rota JS, Hickman CJ, et al.,Outbreak of Measles Among Persons With Prior Evidence of Immunity, New York City, 2011. Clin Infect Dis 2014; 58 (9): 1205-1210. doi: 10.1093/cid/ciu105
- 国立感染症研究所. IASR Vol. 38 p.48-49: 2017年3月号. Available at https://www.niid.go.jp/niid/ja/allarticles/surveillance/2405-iasr/related-articles/related-articles-445/7131-445r01.html
- US CDC.Vaccines and Preventable Diseases. MMR Vaccine Effectiveness and Duration of Protection. Available at https://www.cdc.gov/vaccines/vpd/mmr/hcp/about.html