(IDWR 2003年第23号週)
伝染性単核症(infectious mononucleosis, 以下IM)は思春期から若年青年層に好発し、大部分がEpstein‐Barr ウイルス(EBV)の初感染によっておこる。主な感染経路はEBV を含む唾液を介した感染(一部、輸血による感染も報告されている)であり、乳幼児期に初感染をうけた場合は不顕性感染であることが多いが、思春期以降に感染した場合にIM を発症することが多く、kissing disease とも呼ばれている。EBV の既感染者の約15〜20%は唾液中にウイルスを排泄しており、感染源となりうる 1)。
疫 学
IM は、1889年Pfeiffer らによって腺熱として初めて報告された疾患で、IM という名称は1920年Sprunt とEvans らによって初めて用いられるようになった。その後1932 年にPaul とBunnell が異好抗体(heterophile antibody)を用いた血清学的な診断とIMとの関連について報告し、1937年Davidsohn はこの方法を応用して、さらに簡単で迅速なDavidsohn 吸収試験を開発した。しかし、この方法は特異性に欠けていた。
1964 年、Epstein, Barr らによってアフリカのBurkitt リンパ腫患者から新しいヘルペスウイルスが発見され、Epstein‐Barr virus (EBV)と命名された。IMとEBV との関係が報告されたのは、1968年Henle らによるものが最初である。
日本人でのEBV 抗体保有率に関しては1997年のKusuhara らの報告によると、12 〜23カ月齢児において54.5%〜55.8%であり2)、同じヒトヘルペス科ウイルスであるヒトヘルペスウイルス6(HHV‐6)やヒトヘルペスウイルス7(HHV‐7)に比して、感染時期は遅い。
年齢別抗体保有率は国により異なり、我が国においては2〜3歳までに70%位が感染を受け、20歳代で90%以上が抗体を保有しているのに比して、欧米 では生活習慣の違いなどにより、乳幼児期の感染は20%前後で、それに伴い若年青年層における抗体保有率も低く、IM の発症は本邦より多いと考えられる。
現在の日本においては患者の届け出の義務はないため、正確な患者発生数は不明であるが、米国の報告では、年間一般人口10万人当たり約50人の患者発生が認められている。ただし、感受性のある大学生においては10 万人当たり約5,000人がIM を発症することから、不顕性感染者の数を考慮すると、大学生におけるEBV の感染率は年間10万人当たり約12,000人程度であると見積もられている 1)。
一方我が国においては、好発年齢である思春期以降は勿論のこと、乳幼児期のEBV の初感染においても注意深く観察すれば、IM の症状を認める場合があることが言われており、注意を要する3)。さらに、従来ヒトサイトメガロウイルス(CMV)の妊娠可能年齢における抗体保有率は90%以上であったが、最近70%台に下がってきているという報告もあり、今後のEBV に対する抗体保有率についても注意深く観察する必要がある。
いずれの場合においても、IM の発症機序はEBV に対する細胞性免疫反応の過剰反応であると考えられており、細胞性免疫が発達した思春期以降の方が乳幼児期よりも発症頻度が高いのは、このことによる。
病原体
ほとんどがEBV の初感染によるが、一部サイトメガロウイルス(CMV)、HHV‐6 、アデノウイルス(ADV)、単純ヘルペスウイルス(HSV)、ヒト免疫不全ウイルス(HIV)、A型肝炎ウイルス(HAV)、B型肝炎ウイルス (HBV)、トキソプラズマ、リケッチアによっておこりうる。EBVはヒトヘルペスウイルス科γ亜科に属する約172kbp の2本鎖DNAウイルスで、直径は約150〜220nm である。ヘルペスウイルスの性質上、ひとたび宿主に感染すると一生その宿主に潜伏感染し、免疫抑制状態下で再活性化する性質を有する。
EBV はまず咽頭上皮細胞に感染し、そこで増えたウイルスが、主にEBV の標的細胞であるBリンパ球(一部、Tリンパ球やnatural killer (NK)細胞)に感染する。その機序は、EBV のenvelope蛋白であるgp350/220 と細胞の補体レセプターCD21 との結合で細胞に吸着することである。CD21は主にB リンパ球に発現しているが、T リンパ球、NK 細胞、咽頭上皮を含む上皮細胞にも発現しており、感染のターゲットとなり得る。その後ウイルスはendocytosis により細胞内に取り込まれ、ウイルスDNA はウイルス粒子の中では線状で存在し、潜伏感染状態では環状に変化し、核内で維持される。しかし、この状態ではウイルスは産生されず、一部の遺伝子(EBNA‐1,‐2,‐ 3a,‐3b,‐3c, ‐LP, LMP‐1,‐ 2a,‐ 2b, BARF0, EBER‐1,‐2)のみが発現している潜伏感染状態に入る。再活性化がおこると、まず前早期抗原(immediate early antigen :IEA ;BZLF1, BRLF 1)が作られ、その後早期抗原(early antigen :EA;酵素類)、後期抗原(late antigen :LA ;capsid 蛋白、envelope 蛋白)が作られ、ウイルス粒子の産生が始まる。
EBV がlytic cycle (増殖サイクル)に入るとviral IL‐10(vIL‐10)が産生されることが、Stewart ら(1992年)6)、Taga ら(1995年)7)によって報告されている。IL‐10 はTh1細胞の機能を抑制し、T リンパ球の増殖、IFN‐γ、IL‐2の産生を抑制する。これは逆にB リンパ球の増殖、免疫グロブリンの産生、EBV 感染B リンパ球の増加にもつながる。
(以下はEBV による伝染性単核症に限定する。)
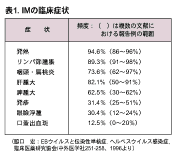
臨床症状1), 3), 5), 8)(表1)
|
4 〜6週間の長い潜伏期を経て発熱、咽頭扁桃炎、リンパ節腫脹、発疹、末梢リンパ球増加、異型リンパ球増加、肝機能異常、肝脾腫などを示す急性感染症である。また、中枢神経症状を呈する症例が認められる。発熱は高頻度に認められ、多くの場合38 ℃以上の高熱で1〜2週間持続する場合が多い。扁桃には偽膜形成を認め、口蓋は発赤が著明で出血斑を認めることもあり、咽頭痛を伴う。リンパ節の腫脹は1〜2週頃をピークとして全身に認められるものの、頚部が主である。 |
|
|
表1. IM の臨床症状 |
発疹は主に体幹、上肢に出現し、斑状、丘疹状の麻疹様あるいは風疹様紅斑であり、その形態は多彩である。アンピシリン(ABPC)を 内服すると薬疹を生じて、鮮明な浸出性紅斑様皮疹や丘疹などを呈す。同時に赤血球沈降速度の亢進や、ポリクローナルな高ガンマグロブリン血症、リウマチ因 子、寒冷凝集素、抗核抗体の産生などが認められる。この現象はEBV によるIM のみならず、CMV によるIM においても認められる。
リンパ球増加は診断基準にも含まれており、特徴的な所見であるが、一部に白血球減少を認める場合もある。異型リンパ球は、Bリンパ球増殖に対しておこった CD4 陽性細胞や、NK 細胞から産生されたサイトカインにより、CD8 陽性cytotoxic T lymphocyte (CTL)が活性化したものであるといわれている。10%から中には50%と著増する場合もあるが、中には数%以下の症例も認められる。CD4/CD8 比はCD4 陽性細胞の減少、CD8 陽性細胞の増加により1以下である場合が多い。
肝機能異常はほとんどの症例で認められるが、AST/ALT の増加は第2週頃をピークとして300〜500IU/L 程度のことが多い。黄疸を伴うことはまれである。なかにはAST/ALT が数千IU/L と著明な肝機能異常を伴うことがあり、注意を要する。
肝脾腫の頻度は表1 に示すとおりで、肝腫大の方が頻度が高い。肝臓は肋骨弓下1〜2 横指触知されることが多い。脾腫に関しては、時に巨大脾腫から脾破裂に至ることもあるため、注意を要する。
合併症として認められる中枢神経症状には、無菌性髄膜炎、脳炎、急性片麻痺、Guillain‐Barre症候群、視神経炎、脳神経麻痺、末梢神経炎、 横断性脊髄炎、急性小脳失調、中枢神経系のリンパ腫などが含まれる。その他まれではあるが、溶血性貧血、血小板減少、再生不良性貧血、B細胞リンパ腫、心 筋炎、心膜炎、肺炎、気道閉塞などの報告もある。通常self‐limited な疾患であるが、遺伝疾患である伴性劣性リンパ球増殖症候群(X‐linked lymphoproliferative syndrome :XLP;Duncan 病)の患者では、先天的にEBV 特異的CTL 活性が誘導されないため、不死化したBリンパ球が減少しないことと、NK活性が低いことも原因となり、致死性伝染性単核症となる。ここでは詳細について触 れないが、IM とは別の病態である慢性活動性EBV 感染症の長期予後は依然不良である。
なお、一般にCMVによる場合は、EBVによる場合に比して、咽頭扁桃炎、巨大脾腫の頻度が少なく、異好抗体を産生しない。
病原診断
|
表2の「3. EBV 抗体検査」にも示されているが、EBVに対する抗体反応検査には多くの種類がある。これらを総合的に判断してその病態を理解することが重要である。 |
|
|
表2. 小児のIM の診断基準(Sumaya を改変) |
VCA およびEA はIgG,IgM,IgA 抗体を測定できる。VCA IgM は通常、初感染急性期に検出されるが、乳幼児では検出されない場合があること、慢性活動性EBV 感染症の場合にも陽性を呈することがあるため、注意を要する。VCA IgG は回復期に上昇してくるが、年長児の方が早く上昇するので、IM の急性期から陽性であることが多く、その後陽性が持続する。一方、VCA IgA は上咽頭癌や慢性活動性EBV 感染症などの特異な病態の時に検出されることが多い。
EA IgG はIM の急性期の終わりから回復期にEBNA 抗体より早く検出され、数カ月の経過で陰性化する。その後再活性化に伴い再び検出されるようになる。EA IgM は急性期のほとんどの症例で検出されるが、検出期間が長いため回復期になっても陽性であることが少なくなく、解釈には注意を要する。
EBNA 抗体は感染後数カ月経過してから検出されるため、IMの急性期では陰性である。しかし、EA IgG とは異なり、その後陽性が持続する。EBNA抗体の上昇が遅く、EA IgM が陰性化してもなおEBNA 抗体陰性の時期がある場合があるので、注意が必要である。
いずれにしても、一つの抗体価のみでEBV 感染症の病態を把握することは困難であり、必ず急性期と4 〜6 週後の回復期、必要ならばさらに数カ月後の複数の血清を用いて結果を判断すべきである。
他に用いられる検査方法としてポールバンネル反応(Paul‐Bunnell reaction test )があるが、最近は上記のEBV 特異的抗体を用いて診断することが多いこと、日本のIM の患者においては陰性例が少なからず存在することから、この方法を用いることは少なくなっている。これは、IM 患者血清中にはヒツジ、ウマ、ウシ、ヤギの赤血球を凝集させる物質(heterophile agglutinin )が存在するが、この凝集素の特異な吸収パターンを利用したものである。
また最近では、分子生物学的手法を用いた診断が行われるようになり、定量的polymerase chain reaction (PCR)法を用いて血漿中のfree EBV genome 量を測定し、診断に応用できるようになってきた。Kimura らは 9)、IM の急性期の95%の症例では血漿1ml 中に平均10 2.4個のウイルスが存在するが、その後徐々に減少し、1カ月以内に消失すると報告している。一方、重症例であるEBV associated hemophagocytic syndrome(EB‐VAHS)や移植後のpost‐transplant lymphoproliferative disorder (PTLD)症例などでは著明にウイルス量が増加しており、血漿1ml 中のウイルス量は10 5.5〜10 7.4個にまで達するとのことである。
治療・予防
特異的な治療法は現時点では存在しないことと、一般的にはself‐limiting な疾患であるため、対症療法で治療することがほとんどである。IM の診断が得られる前に抗菌薬を使う例も見られるが、ABPC を内服すると薬疹を認めることがあるため、この薬剤の使用は避けるべきである。また、重症例や致死的IM が疑われる場合には、抗ウイルス剤を併用したウイルス特異的な治療法が必要になると考えられる。Acyclovir は鼻咽頭へのウイルスの排泄は抑制するものの、症状の改善には効果が認められていない。Ganciclovir, foscarnet, vidarabine (Ara‐A)などの有効例が報告されているが、いずれも重症型の慢性活動性EBV 感染症などに用いられているのみである。また、
最近移植医療の進歩に伴い、EBV によるPTLD の発症が問題になっているが、そのような病態の場合には、化学療法やEBV 特異的CTL 療法 10)、抗CD20単クローン抗体 11)、造血幹細胞移植などの治療法が試みられている。
【引用文献】
1 )Katz BZ, Miller G: Epstein‐ Barr virus infections. Krugman's Infectious Diseases of Children,10th ed.1998, pp98‐115 Mosby‐Year Book, Inc.
2 )Kusuhara K, et al. Breast milk is not a significant source for early Epstein‐Barr virus or human herpesvirus 6 infection in infants: a seroepidemiologic study in 2 endemic areas of human T‐cell lymphotropic virus type I in Japan. Microbiol Immunol. 1997;41(4): 309‐12.
3 )脇口宏、高田賢蔵、今井章介:EB ウイルスと伝染性単核症、EB ウイルス、EB ウイルスとリンパ腫. ヘルペスウイルス感染症 監修・編集 新村眞人、山西弘一. 発行・臨床医薬研究 協会. 1996; 251‐258
4)Kieff E, Rickinson AB: Epstein‐ Barr virus and its replication. In Fields Virology 4th ed. 2001 pp2511‐2573 by Lippincott Williams &Wilkins
5)Rickinson AB, Kieff E:Epstein‐Barr virus. In Fields Virology 4th ed. 2001 pp2575‐2627 by Lippincott Williams &Wilkins
6)Stewart JP, Rooney CM.The interleukin‐10 homolog encoded by Epstein‐Barr virus enhances the reactivation of virus‐ specific cytotoxic T cell and HLA‐unrestricted killer cell responses. Virology. 1992;191(2): 773‐82.
7)Taga H, et al. Human and viral interleukin‐ 10 in acute Epstein‐ Barr virus‐induced infectious mononucleosis. J Infect Dis.1995 ;171(5):1347‐ 50.
8)Sumaya et al.:Epstein‐Barr virus infectious mononucleosis in children. I. Clinical and general laboratory findings. Pediatr 1985;75 :1003‐10
9)Kimura H, et al. Monitoring of cell‐free viral DNA in primary Epstein‐ Barr virus infection. Med Microbiol Immunol (Berl). 2000 ;188(4):197‐202.
10)Khanna R, et al.. Activation and adoptive transfer of Epstein‐ Barr virus‐specific cytotoxic T cells in solid organ transplant patients with posttransplant lymphoproliferative disease.Proc Natl Acad Sci USA.1999 ;96(18): 10391‐6.
11)Faye A,et al.Anti‐CD20 monoclonal antibody for post‐ transplant lymphoproliferative disorders. Lancet. 1998; 352(9136): 1285.
(国立感染症研究所感染症情報センター 多屋馨子)