国立感染症研究所
(2024年1月22日 改訂)
疫学
ヒストプラスマ症は、Histoplasma属菌による感染症であり、主な原因菌種はHistoplasma capsulatumとHistoplasma duboisiiの2種である。Histoplasma属菌は二形性真菌であり、自然環境内では菌糸形、感染した宿主内では酵母形となる。本菌は土壌中に生息しており、コウモリや鳥の糞などに特に多く、汚染地域における土木建築工事やコウモリの生息する洞窟探検などによる集団発生がしばしば報告されている。本邦での報告例は、2018年末までに約100例程度である。南極大陸を除く世界各地の土壌から分離される真菌であり、特に渓谷領域との関連性が深い。
- H. capsulatumによるカプスラツム型肺ヒストプラスマ症は北米・中南米・東南アジア・中国・オーストラリア・インドなど世界中の熱帯、亜熱帯地域を中心として発生している。特に米国中央部のミシシッピー川流域 (ミシシッピー渓谷〜オハイオ渓谷) を中心に報告例が多く、米国では毎年50万人程度が感染する米国最大の真菌性風土病である。近年では中国の特に揚子江沿い、インドからも多数の症例報告が出ている。主な感染経路は経気道感染であり、分生子を含むコウモリやトリの糞、汚染された土壌などが感染源となりうる。病型は宿主側の免疫状態によって様々であるが、固形臓器移植やHIV患者、免疫抑制薬使用中の患者などの細胞性免疫不全状態においては、進行性播種性の病態を呈し、致死的となりうる。
- H. duboisiiによるズボアジィ型ヒストプラスマ症は中央アフリカを中心としてアフリカ大陸で主に報告され、ナイジェリア、ウガンダ、セネガル、コンゴ民主共和国などで報告例がある。臨床的な特徴として、皮膚(結節・潰瘍・乾癬様病変・冷膿瘍など)や骨(頭蓋骨・肋骨・脊椎病変)が主体であり、肺病変は呈さない。
臨床症状
Histoplasma属に曝露したヒトの大半 (90%以上) は無症状あるいはごく軽度のインフルエンザ様の症状を呈するのみで自然軽快し、医療機関に受診せず、ヒストプラスマ症と認識されないことも多い。しかしながら、宿主側の免疫状態により、曝露したヒトの一部では、下記の型に分類される臨床症状を呈することがある。
急性肺ヒストプラスマ症 (Acute pulmonary histoplasmosis)
主として免疫正常な宿主に生じる。潜伏期は7〜21日程度であり、大半の患者は14日目までに何らかの症状を呈する。症状としては発熱、悪寒、咳嗽、頭痛、胸痛などを生じ、また、多量の真菌に曝露された場合には重症化し、人工呼吸管理が必要になることもある。通常は自然軽快するため治療は不要であり、多くの症状は発症後10日以内には軽快するが、多量の真菌に曝露された場合には数週間に渡り症状が持続することもある。治療する場合には、軽症〜中等症例ではイトラコナゾール内服、重症例ではリポソーマル・アムホテリシンB静注が推奨される。
慢性肺ヒストプラスマ症 (Chronic pulmonary histoplasmosis)
疫学的には、慢性の呼吸器疾患を有する男性患者に発症することが多いと報告されている。症状として、微熱、慢性湿性咳嗽、体重減少、呼吸困難などを呈し、結核に類似するが、血痰は稀である。画像上も空洞形成が認められることがあり、結核との鑑別がしばしば困難となる。治療は臨床的な反応を見ながら、イトラコナゾール内服を少なくとも12ヵ月継続する。
播種性ヒストプラスマ症 (Disseminated histoplasmosis)
播種性ヒストプラスマ症のリスク因子としては、高齢者、HIV患者、血液悪性疾患、固形臓器/造血幹細胞移植、免疫抑制薬の使用、TNF-α阻害薬など、細胞性免疫不全が主として挙げられる。病型として急性型、亜急性型、慢性型に分けられる。症状としては発熱、体重減少、食思不振に加え、肝脾腫、リンパ節腫大、皮膚・粘膜病変などを形成するが、慢性型では症状に乏しいことも多く、倦怠感のみで発熱などの症状を欠くことも多い。重症例では敗血症性ショックや多臓器不全、播種性血管内凝固、腎不全、急性呼吸不全などを呈する。また、亜急性型では多彩な病態を呈することが特徴的であり、消化管病変や心内膜炎、髄膜炎や頭蓋内巣病変、副腎病変などを認める症例もある。治療としてリポソーマル・アムホテリシンBが第一選択であり、その後少なくとも12ヵ月間はイトラコナゾール内服を継続することが望ましい。慢性型の場合はイトラコナゾール内服治療を少なくとも12ヵ月継続する。
診断
Histoplasma属菌はBSL3(バイオセーフティーレベル3)に分類されている病原体であり、感染力が極めて強く取扱には十分な注意が必要である。検査室内で臨床検査技師や研究者が感染する事故が起こる可能性が高い。ヒストプラスマ症が疑われた場合は、専門の施設(千葉大学真菌医学研究センター臨床感染症分野もしくは国立感染症研究所真菌部)に対応について相談することが望ましい。
分離培養
喀痰・気管支肺胞洗浄液・肺生検標本などの検体をポテトデキストロース培地に塗布し、25℃で最低4週間培養する。寒天培地は通常の平板培地ではなく、フィルターキャップ付の斜面培地を作製する。培養陽性となれば、遺伝子解析により菌種同定を行う。あわせて、鏡検により大分生子の形成を確認する(図1)。
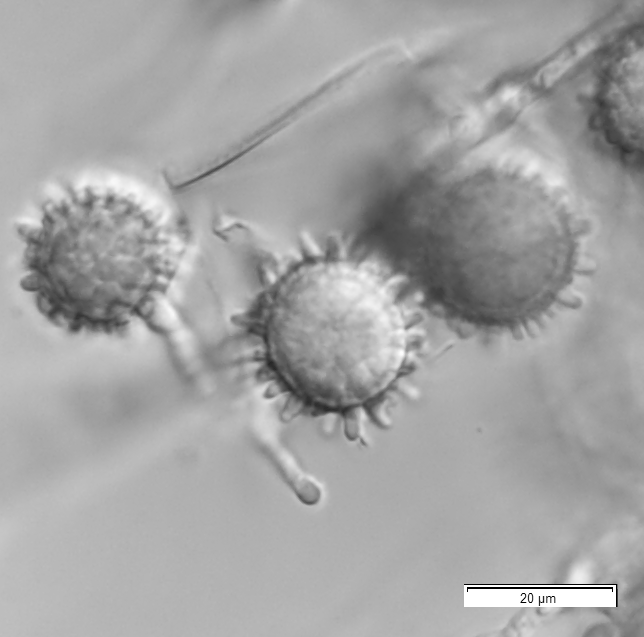
図1 H. capsulatumの大分生子
菌株の遺伝子同定
まず、菌体から煮沸によりDNAを抽出する。ribosomal RNA(rRNA)遺伝子間に存在するinternal transcribed spacer (ITS)領域、またはrRNA遺伝子中のlarge subunit D1/D2領域を増幅するプライマーにてPCRを行い、増幅産物が得られた場合には、この産物について塩基配列解析を行ったのち、国際的に公表されているデータベース(MycoBankなど)を参照して菌種を同定する。
病理組織学的検査
グロコット染色により、小型の酵母様真菌が観察できる。
免疫学的診断法
抗体検査は市販化されたキットは入手困難であり、ほとんど行われない。IMMY社の抗原検査キットにより、尿検体(および参考値であるが血清検体)を用いて抗原検査を行う。
(国立感染症研究所 真菌部)