1.スフィンゴ脂質の化学構造と生物界での分布
スフィンゴ脂質sphingolipidとは、スフィンゴイド塩基sphingoid baseとよばれる長鎖アミノアルコールlong-chain amino alcoholを骨格としてもつ一群の脂質です(図1)[1-4]。哺乳動物細胞におけるスフィンゴ脂質のスフィンゴイド塩基は、主にスフィンゴシンsphingosineであり、そのアミノ基にアシル基がアミド結合するとセラミドとなり、そして、セラミドにさまざまな親水性の頭部が結合して複合スフィンゴ脂質complex sphingolipids (分子中にリン、イオウ、アミノ酸、糖などを含むスフィンゴ脂質)となります(図1)。
図1
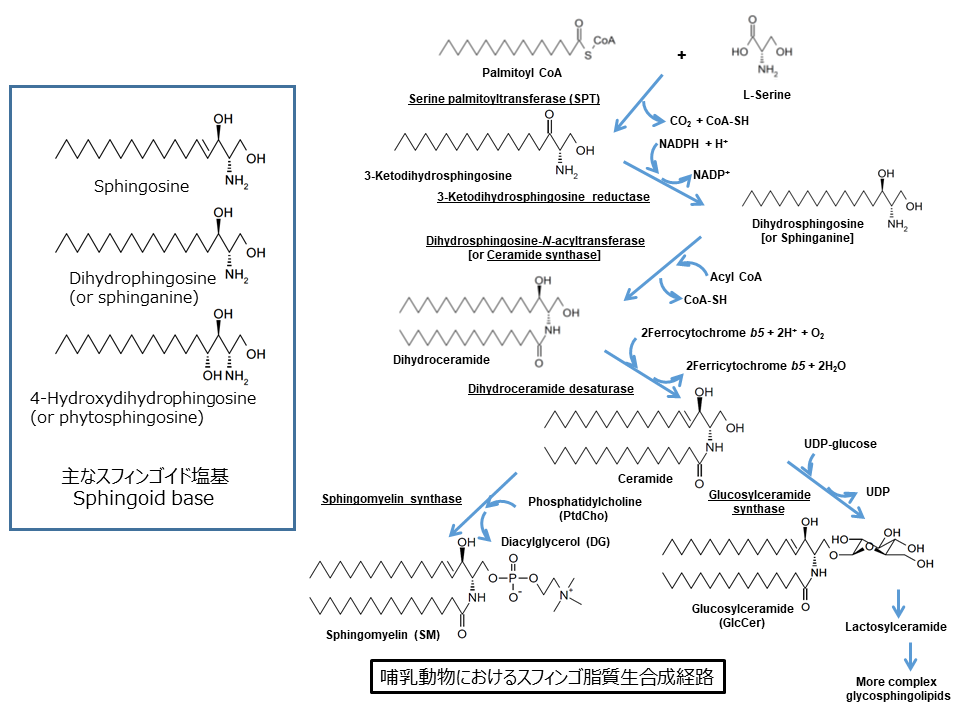
スフィンゴ脂質の基本骨格である長鎖アミノアルコール構造をスフィンゴシンと命名したのは、この脂質群を最初に発見したドイツの医生化学者Johann L. W. Thudichum (1829-1901)です。Thudichum(英語圏の人はスディヒャムもしくはツディヒャムと発音しているようです)は、臓器から溶媒抽出しにくい性質をもったこの不思議な脂質群を、「謎」を意味するSphinxもしくは「固く結合する」を意味するsphingeinにちなんで命名したといわれております(参考図書:山川民夫『糖脂質物語』、講談社学術文庫)。
スフィンゴ脂質の命名に関する追加情報とSphinxについては本章の末尾(次ページ)に余談をつけています。
セラミドにホスホコリンphoshocholineがエステル結合したリン脂質は、スフィンゴミエリンsphingomyelinとよばれ、哺乳動物細胞の総リン脂質の5-10%を占めています。下等動物では、ホスホコリンではなくホスホエタノールアミンphosphoethanolamineやホスホノエタノールアミンphosphonoethanolamine(生物界では珍しいC-P結合がある!)がセラミドにエステル結合したスフィンゴリン脂質がしばしばみられます(図2)[5, 6]。酵母やカビおよび植物は、スフィンゴミエリンをもちませんが、高等動物ではみられないホスホイノシトール含有スフィンゴ脂質phosphoinositol-containing sphingolipidsをもちます(図2)[7-10]。
図2
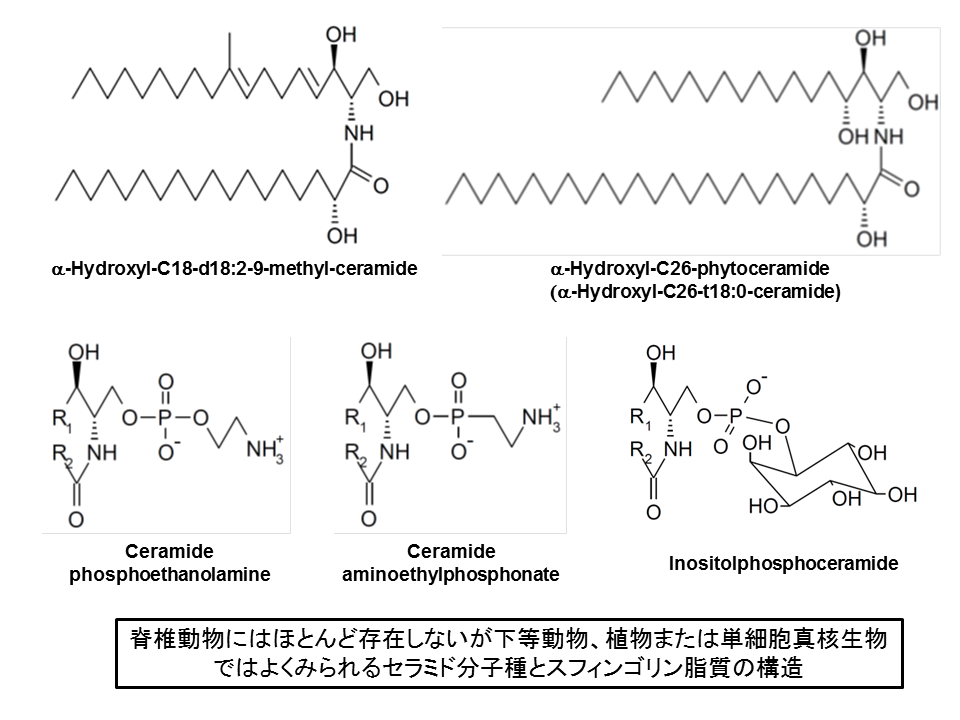
糖のついたスフィンゴ脂質(スフィンゴ糖脂質glycosphingolipids)もまた生物界に広く存在しています[5, 11]。糖鎖部分の構造はとても多様性に富んでおり、おなじ生物個体のなかでさえスフィンゴ糖脂質の発現パターンは、細胞の種類によってかなりちがいます[12-14]。
細菌には、例外的な細菌をのぞいてスフィンゴ脂質はありません。スフィンゴモナスSphingomonas属の細菌はグラム陰性細菌でありながらリポ多糖がなく、その代わりにスフィンゴ糖脂質を表面構成因子としてもっております[15]。スフィンゴバクテリウムSphingobacterium属からはホスホイノシトール含有スフィンゴ脂質がみつかっていますし[16]、歯周病原性細菌Porphyromonas gingivalisもスフィンゴ脂質を合成できる例外的な細菌です[17]。また、動物細胞内に寄生して増殖するクラミジアChlamydia菌は宿主細胞のつくるスフィンゴ脂質を菌の増殖に利用しています[18]。
グリセロールglycerolを骨格としてもつ脂質群は、グリセロ脂質glycerolipidsとよばれ、細菌からヒトまでほぼすべての生物に存在しています。ヒトとパン酵母のあいだで、グリセロ脂質の構造はほとんど差がありませんが、スフィンゴ脂質の構造は上で述べたようにおおきく異なります[4]。このスフィンゴ脂質の構造の多様性は、なにかしらの進化のうえでの意義とリンクしていると想像されますもののその意義の多くは謎のままです。
2.哺乳動物におけるスフィンゴ脂質の生合成経路
スフィンゴ脂質の生合成では、セリンパルミトイル転移酵素(serine palmitoyltransferase; SPT)が触媒するセリンとパルミトイル palmitoyl CoAとの縮合反応からはじまり、いくつかの反応を経てセラミドとなります(図1)[2, 4]。哺乳動物細胞においては、セラミドはさらにスフィンゴミエリンもしくはグルコシルセラミドglucosylceramideへと変換され、グルコシルセラミドはさらに複雑なスフィンゴ糖脂質へと変換されます(図1)。
3.スフィンゴ脂質の生理と病理
スフィンゴ脂質は、多くの生理機能に関与していることがわかってきています[12, 13, 19, 20]。そして、その代謝の異常は、いくつかの遺伝病の原因と知られるだけでなく[21-23]、成人病やガンそして認知症といった現代の主要疾病にも関わっています[24, 25]。最近では、スフィンゴ脂質代謝をターゲットとした病気の予防や治療さえも現実のものとなってきています[26-28]。また、スフィンゴ脂質は、当研究所のミッションである感染症研究にかかわりが深い脂質でもあります[29-31]。
本ホームページ内でスフィンゴ脂質の生理機能や病態との関わりの詳細を説明することは、当研究部の研究成果を紹介するというこのホームページの目的を超えますので控えますが、関連する総説を文中に引用しましたので、興味のある方はそれら総説をご覧ください。また、この課題に詳しい日本の研究グループのホームページもおおいに参考になると思います。
4.私たちがスフィンゴ脂質の研究に参画したきっかけなど
今でこそ注目もされるようになったスフィンゴ脂質ではありますが、現部長の花田が研究員として本研究所に職を得た1980年代の終わりころは、スフィンゴ脂質を取り扱う研究者の数も少なく、生合成経路や生理的意義といった基本的なことがらでさえも不明な点がいろいろと残されておりました。そこで、私たちは、スフィンゴ脂質の生合成の最初のステップを行うSPTの活性がほとんど失われるようになる動物細胞変異株を分離して、この変異株の解析から、スフィンゴ脂質が動物細胞の生育に必須であることなどをあきらかにしてきました[32-39]。このような地道な研究を進めているうちに、細胞内セラミド輸送が欠損している変異細胞にめぐり会うことになり、それはセラミド選別輸送を担う分子装置CERTの発見に結びついてゆきます。この経緯は本ホームページの他の項目、III.哺乳動物細胞におけるセラミド輸送に関する研究をご覧ください。
余談1 Thudichumの著書とスフィンゴミエリン、スフィンゴシンの登場
スフィンゴミエリンsphingomyelin、スフィンゴシンsphingosineという用語が初めて文献上で登場したのは、1884年に出版されたJohann Ludwig Wilhelm Thudichumの著書"A Treatise on the Chemical Constitution of the Brain"においてと思われます。この本の内容はwebで見ることも可能です(https://archive.org/stream/b23984570/b23984570_djvu.txt)。また、復刻版(by D.L. Drabkin, Archon Books, Hamden CT, 1962)も出ており、それを中古本として海外から購入することができましたので以下に写真付きで紹介します。

この本の本文中でSphingomyelinとsphingosine (この本ではsphingosinという表記)という用語が最初に出てくるのは第一章のイントロダクションです。そこでの記載によると、Thudichum自身が予備的な解析から1874年に報告していたapomyelinを本格的に解析し、この二窒素一リン酸含有脂質(dinitrogenized monophosphatidates)をsphinomyelinと名付け直したとのこと。ただし、ここでは何故sphingoという接頭辞のような言葉を思いついたのかには触れていません。その少し後にsphingomyelinの分解成分としてsphingosinという用語が登場しますがsphingoの意味はここでも記載されていません。そして、脳から抽出・分離した様々な脂質群の化学的性質を記載した「実験結果」に相当する章において、セレブロシドcerebroside(現在でいうところのガラクトシルセラミドgalactosylceramide) を化学分解した後に得られる冷エーテル難溶性物質を以下のように記載しています(上図の右下パネル参照)。
“to which, in commemoration of the many enigmas which it presented to the inquirer, I have given the name of Sphingosin,”
「(アルカロイドとしての特性をもつこの冷エーテル難溶性物質に対して)探究者たる私に多くの謎を呈してきた記念として、Sphingosinという名を与えることにした」
Sphinxという語句こそ出てきませんが、この記載からSphingosin はSphinxにつながるネーミングであると考えてよいでしょう。
先述した1874年に出版された予備報告の内容を知ることが今のところ私にはできません。よって、Sphingosinのネーミングとその説明の初登場はこの” Thudichum, J.L.W. (1874) Researches on the chemical constitution of the brain. Report of the Medical Officer of the Privy Council and Local Government Board, 3 :113 “のほうにあるのかもしれないことをお断りしておきます。 しかし、米国ジョージア工科大学のAlfred Merrill, Jr.博士(スフィンゴ脂質分野の著名な研究者の一人であり、その歴史に関しての造詣も深い)にメールで尋ねたことろ、同氏は1874年の報告の写しも持っており、その中ではまだsphingosinという文言は出てきていないと回答をくれました。
ところで、写真の復刻本の本を編んだDrabkinが復刻当時(1962年)の知識をもって作成した用語説明GlossaryのSphingosinの項に以下の記載があります。
”The name is derived from the Greek, sphingein, meaning: to bind tight.”
「この名称は、固く結ぶを意味するギリシャ語のsphingeinに由来している」
Drabkinのこの記載の由来がThudichumの書いた文章のどこにあるのか私にはまだ見つけられておりません。一方、Sphinxという名詞そのものがギリシャ語のsphingeinという動詞に由来するという説は別途存在していて、また、この説への反論もあるようです。言葉の成り立ちからして謎めいているわけですね。
余談2 スフィンクス
女人の顔と獣の胴体をもつスフィンクスSphinxは、古代エジプトの神聖獣であり、王家を守るためにいまもピラミッドの近くに座っております。
少し時代が下がったギリシア神話中の怪物スフィンクスは、テーベThebes(古代地名はテバイThebai)の近くの山に住み、通りかかる旅人に謎々を質問して、答えられぬと食べていました。誰も正解を答えられずに大変迷惑していたところ、旅人オイディプスOedipusが二つの謎にあっさりと正解し、スフィンクスは自らを恥じて崖から身を投げました。オイディプスは、つい先ごろ王を失ったテーベ市民に認められ新しい王となり、未亡人たる王妃と結婚します。しかしなんと、オイディプスは先の王とその妃との実子なのです。その昔、神託によって自分の子供に殺されるから子供をもうけるなとされていた王は、それでも酔った勢いで妻を妊娠させてしまいます。王は、生まれたばかりの男の子を殺せと命じましたが、不憫に思った部下によって密かに他人の手にわたされたその子は、オイディプスと名付けられ、親子お互いを知らぬままに育ちます。青年オイディプスは、両親を殺すことになるからテーベには行くなと神託されていたにもかかわらずテーベに向かい、旅をしていた先王をふとした喧嘩がもとで刺殺してしまいますが、彼が下手人とは誰も知らないままに、スフィンクスの謎に答えてテーベの王になってしまうのです。つまるところ、オイディプスは実父を殺して王となり、実母と結婚したことになります。そのことをあとで知り、王妃は縊死し、オイディプスは気が狂って自分の両眼をつぶし街からも追い出されてしまうというのがこの物語の結末です。参考図書:串田孫一『ギリシア神話』(旺文社文庫など)
幾分なりともハッピーな結末が用意されている今どきの物語に比べると、オイディプスの物語はなんとも不条理に満ちたものですが、神の定めた運命には逆らえないと信じるならば、これはこれで条理なのかもしれません。
精神分析学者ジークムント・フロイト(Sigmund Freud, 1856-1939)は、幼い男子が母親を独り占めしたくて父親を憎みがちであることを指摘し、この状態をオイディプスの父親殺し・母親姦の物語にちなんで「オイディプス・コンプレックス(日本ではエディプス・コンプレックスとよくよばれる)」と名付けました。
なお、スフィンクスがオイディプスに問うた二つの謎とは以下のようなものです。
「朝は四本足、昼は二本足、夕方は三本足。これは何か?」
「二人の姉妹で、一方が他を生み、また反対の一方も他方を生むものは何か?」
答えの気になる方はギリシア神話をひもといてみてください。
引用文献
(digital object identifier, doi: わかる論文のみ記載)
[1] Karlsson KA (1970) On the chemistry and occurrence of sphingolipid long-chain bases, Chem Phys Lipids, 5, 6-43. doi:
[2] Hanada K (2003) Serine palmitoyltransferase, a key enzyme of sphingolipid metabolism, Biochim Biophys Acta, 1632, 16-30. doi:10.1016/S1388-1981(03)00059-3.
[3] Merrill AH, Jr. (2011) Sphingolipid and glycosphingolipid metabolic pathways in the era of sphingolipidomics, Chem Rev, 111, 6387-6422. doi: 10.1021/cr2002917.
[4] Hanada K (2014) Co-evolution of sphingomyelin and the ceramide transport protein CERT, Biochim Biophys Acta, 1841, 704-719. [Corrigendum (2014) 1841, 1561-1562; doi: 10.1016/j.bbalip.2014.08.002].
[5] Hori T, Sugita M (1993) Sphingolipids in lower animals, Prog Lipid Res, 32, 25-45. doi:
[6] Garrett TA, Schmeitzel JL, Klein JA, Hwang JJ, Schwarz JA (2013) Comparative lipid profiling of the cnidarian Aiptasia pallida and its dinoflagellate symbiont, PLoS One, 8, e57975. doi: 10.1371/journal.pone.0057975.
[7] Dickson RC (2008) Thematic review series: sphingolipids. New insights into sphingolipid metabolism and function in budding yeast, J Lipid Res, 49, 909-921. doi: 10.1194/jlr.R800003-JLR200.
[8] Sperling P, Heinz E (2003) Plant sphingolipids: structural diversity, biosynthesis, first genes and functions, Biochim Biophys Acta, 1632, 1-15. doi:
[9] Berkey R, Bendigeri D, Xiao S (2012) Sphingolipids and plant defense/disease: the "death" connection and beyond, Front Plant Sci, 3, 68. doi: 10.3389/fpls.2012.00068.
[10] Ternes P, Wobbe T, Schwarz M, Albrecht S, Feussner K, Riezman I, Cregg JM, Heinz E, Riezman H, Feussner I, Warnecke D (2011) Two pathways of sphingolipid biosynthesis are separated in the yeast Pichia pastoris, J Biol Chem, 286, 11401-11414. doi: 10.1074/jbc.M110.193094.
[11] Wiegandt H (1992) Insect glycolipids, Biochim Biophys Acta, 1123, 117-126. doi:
[12] Hakomori SI (2008) Structure and function of glycosphingolipids and sphingolipids: recollections and future trends, Biochim Biophys Acta, 1780, 325-346. doi: 10.1016/j.bbagen.2007.08.015.
[13] Furukawa K, Ohkawa Y, Yamauchi Y, Hamamura K, Ohmi Y, Furukawa K (2012) Fine tuning of cell signals by glycosylation, J Biochem, 151, 573-578. doi: 10.1093/jb/mvs043.
[14] Inokuchi J (2011) Physiopathological function of hematoside (GM3 ganglioside), Proc Jpn Acad Ser B Phys Biol Sci, 87, 179-198. doi:
[15] Kawasaki S, Moriguchi R, Sekiya K, Nakai T, Ono E, Kume K, Kawahara K (1994) The cell envelope structure of the lipopolysaccharide-lacking gram-negative bacterium Sphingomonas paucimobilis, J Bacteriol, 176, 284-290. doi:
[16] Naka T, Fujiwara N, Yano I, Maeda S, Doe M, Minamino M, Ikeda N, Kato Y, Watabe K, Kumazawa Y, Tomiyasu I, Kobayashi K (2003) Structural analysis of sphingophospholipids derived from Sphingobacterium spiritivorum, the type species of genus Sphingobacterium, Biochim Biophys Acta, 1635, 83-92. doi:
[17] Nichols FC, Riep B, Mun J, Morton MD, Bojarski MT, Dewhirst FE, Smith MB (2004) Structures and biological activity of phosphorylated dihydroceramides of Porphyromonas gingivalis, J Lipid Res, 45, 2317-2330. doi: 10.1194/jlr.M400278-JLR200.
[18] van Ooij C, Kalman L, van I, Nishijima M, Hanada K, Mostov K, Engel JN (2000) Host cell-derived sphingolipids are required for the intracellular growth of Chlamydia trachomatis, Cell Microbiol, 2, 627-637. doi:
[19] Hannun YA, Obeid LM (2008) Principles of bioactive lipid signalling: lessons from sphingolipids, Nat Rev Mol Cell Biol, 9, 139-150. doi: 10.1038/nrm2329.
[20] Zheng W, Kollmeyer J, Symolon H, Momin A, Munter E, Wang E, Kelly S, Allegood JC, Liu Y, Peng Q, Ramaraju H, Sullards MC, Cabot M, Merrill AH, Jr. (2006) Ceramides and other bioactive sphingolipid backbones in health and disease: lipidomic analysis, metabolism and roles in membrane structure, dynamics, signaling and autophagy, Biochim Biophys Acta, 1758, 1864-1884. doi: 10.1016/j.bbamem.2006.08.009.
[21] Kolter T, Sandhoff K (2006) Sphingolipid metabolism diseases, Biochim Biophys Acta, 1758, 2057-2079. doi: 10.1016/j.bbamem.2006.05.027.
[22] Auer-Grumbach M (2008) Hereditary sensory neuropathy type I, Orphanet J Rare Dis, 3, 7. doi: 10.1186/1750-1172-3-7.
[23] Vitner EB, Platt FM, Futerman AH (2010) Common and uncommon pathogenic cascades in lysosomal storage diseases, J Biol Chem, 285, 20423-20427. doi: 10.1074/jbc.R110.134452.
[24] Holland WL, Summers SA (2008) Sphingolipids, insulin resistance, and metabolic disease: new insights from in vivo manipulation of sphingolipid metabolism, Endocr Rev, 29, 381-402. doi: 10.1210/er.2007-0025.
[25] Hla T, Dannenberg AJ (2012) Sphingolipid signaling in metabolic disorders, Cell Metab, 16, 420-434. doi: 10.1016/j.cmet.2012.06.017.
[26] Zeidan YH, Hannun YA (2007) Translational aspects of sphingolipid metabolism, Trends Mol Med, 13, 327-336. doi: 10.1016/j.molmed.2007.06.002.
[27] Chiba K, Kataoka H, Seki N, Shimano K, Koyama M, Fukunari A, Sugahara K, Sugita T (2011) Fingolimod (FTY720), sphingosine 1-phosphate receptor modulator, shows superior efficacy as compared with interferon-beta in mouse experimental autoimmune encephalomyelitis, Int Immunopharmacol, 11, 366-372. doi: 10.1016/j.intimp.2010.10.005.
[28] Garofalo K, Penno A, Schmidt BP, Lee HJ, Frosch MP, von Eckardstein A, Brown RH, Hornemann T, Eichler FS (2011) Oral L-serine supplementation reduces production of neurotoxic deoxysphingolipids in mice and humans with hereditary sensory autonomic neuropathy type 1, J Clin Invest, 121, 4735-4745. doi: 10.1172/JCI57549.
[29] Hanada K (2005) Sphingolipids in infectious diseases, Jpn J Infect Dis, 58, 131-148. (Open access: https://www0.niid.go.jp/JJID/58/131.pdf)
[30] Heung LJ, Luberto C, Del Poeta M (2006) Role of sphingolipids in microbial pathogenesis, Infect Immun, 74, 28-39. doi: 10.1128/IAI.74.1.28-39.2006.
[31] Zhang K, Bangs JD, Beverley SM (2010) Sphingolipids in parasitic protozoa, Adv Exp Med Biol, 688, 238-248. doi:
[32] Hanada K, Nishijima M, Akamatsu Y (1990) A temperature-sensitive mammalian cell mutant with thermolabile serine palmitoyltransferase for the sphingolipid biosynthesis, J Biol Chem, 265, 22137-22142. (Open access: http://www.jbc.org/content/265/36/22137.long)
[33] Hanada K, Nishijima M, Kiso M, Hasegawa A, Fujita S, Ogawa T, Akamatsu Y (1992) Sphingolipids are essential for the growth of Chinese hamster ovary cells. Restoration of the growth of a mutant defective in sphingoid base biosynthesis by exogenous sphingolipids, J Biol Chem, 267, 23527-23533. (Open access: http://www.jbc.org/content/267/33/23527.long)
[34] Hanada K, Nishijima M, Akamatsu Y, Pagano RE (1995) Both sphingolipids and cholesterol participate in the detergent insolubility of alkaline phosphatase, a glycosylphosphatidylinositol-anchored protein, in mammalian membranes, J Biol Chem, 270, 6254-6260. (Open access: http://www.jbc.org/content/270/11/6254.long)
[35] Hanada K, Hara T, Fukasawa M, Yamaji A, Umeda M, Nishijima M (1998) Mammalian cell mutants resistant to a sphingomyelin-directed cytolysin. Genetic and biochemical evidence for complex formation of the LCB1 protein with the LCB2 protein for serine palmitoyltransferase, J Biol Chem, 273, 33787-33794. (Open access: http://www.jbc.org/content/273/50/33787.long)
[36] Hanada K, Hara T, Nishijima M (2000) Purification of the serine palmitoyltransferase complex responsible for sphingoid base synthesis by using affinity peptide chromatography techniques, J Biol Chem, 275, 8409-8415. (Open access: http://www.jbc.org/content/275/12/8409.long)
[37] Hanada K, Mitamura T, Fukasawa M, Magistrado PA, Horii T, Nishijima M (2000) Neutral sphingomyelinase activity dependent on Mg2+ and anionic phospholipids in the intraerythrocytic malaria parasite Plasmodium falciparum, Biochem J, 346 Pt 3, 671-677. (Open access: http://www.biochemj.org/bj/346/0671/bj3460671.htm)
[38] Bejaoui K, Uchida Y, Yasuda S, Ho M, Nishijima M, Brown RH, Jr., Holleran WM, Hanada K (2002) Hereditary sensory neuropathy type 1 mutations confer dominant negative effects on serine palmitoyltransferase, critical for sphingolipid synthesis, J Clin Invest, 110, 1301-1308. doi: 10.1172/JCI16450.
[39] Yasuda S, Nishijima M, Hanada K (2003) Localization, topology, and function of the LCB1 subunit of serine palmitoyltransferase in mammalian cells, J Biol Chem, 278, 4176-4183. doi: 10.1074/jbc.M209602200. (Open access: http://www.jbc.org/content/278/6/4176.long).
花田賢太郎(感染研 品質保証・管理部、細胞化学部併任)
(2013年2月10日)(2014年3月31日 改訂)(2016年10月18日 図1::GlcCer構造図改訂)(2017年1 月13 日 余談1追加)
(2018年11月19日 図1:Dihydroceramide desaturase反応改訂)(2021年4月1日 所属更新)
関連する他のページ一覧
II. スフィンゴ脂質について(このページ)
IV. 病原体による宿主脂質ハイジャック機序の解明と創薬への応用
VI. Vero細胞の物語 ~その樹立からゲノム構造の決定、そして未来へ~
その他の記事
2. スフィンゴ脂質およびセラミドの命名事始め(外部サイトへリンク)
3. セラミド研究史概略(外部サイトへリンク)
*Hanada K (2014) Co-evolution of sphingomyelin and the ceramide transport protein CERT,
Biochim Biophys Acta, 1841, 704-719. doi: 10.1016/j.bbalip.2013.06.006 [Corrigendum (2014) 1841, 1561-1562; doi: 10.1016/j.bbalip.2014.08.002].