(2023年9月13日改訂)
- エルシニア属細菌の一種,ペスト菌(Yersinia pestis)感染に起因する全身性の侵襲性感染症.
- 動物由来感染症.げっ歯類を保菌宿主とし,節足動物(主にネズミノミ属のノミ)によって伝播される.ペスト菌感染動物を感染源とする直接感染もある.
- 肺ペスト患者から排出された気道分泌液により,ヒトーヒト間で飛沫感染する場合がある.
- 潜伏期間は通常1〜7日.感染ルートや臨床像によって腺ペスト,肺ペスト,および敗血症型ペストに分けられる.
- 治療薬として,フルオロキノロン系,アミノグリコシド系もしくはテトラサイクリン系の抗菌薬が使用され,その投薬期間は10〜14日間である.
- 適切な抗菌薬による治療が行われなかった場合,腺ペストでの死亡率は30〜60%である.肺ペストの場合はさらに死亡率は高まる.
- 抗生物質の発見前には全世界的な大流行が幾度か記録されており,特にヨーロッパでは黒死病として古くから恐れられてきた.近年の流行は,アフリカ,南米で報告がある.北米やアジアでも散発事例が報告されている.
臨床症状[1]
1)腺ペスト
腺ペストはペスト菌保有ノミによる吸血や,感染した動物(死亡個体を含む)との接触により傷口や粘膜から感染する.感染成立後,ペスト菌は感染部位の所属リンパ節へ移行する.リンパ節では菌の増殖が起こり,リンパ節組織の壊死,膿瘍形成がおこる.この結果,リンパ節はクルミないしアヒル卵大に腫大し,痛みが生じる.臨床症状としては,通例3~7日の潜伏期の後,リンパ節の腫脹に加え,発熱,頭痛,悪寒,倦怠感などの全身性の症状が現れる.ペスト菌が侵入部位で増殖した場合,化膿性潰瘍や出血性炎症を形成すること(皮膚ペストとも呼ばれる)があるがその頻度は高くない.
2)敗血症型ペスト
ペスト患者の約10%では,リンパ節の腫大などの局所症状を呈さず,血流感染から敗血症へ移行することがある.腺ペストの状態で,適切な治療が行われなかった場合,リンパ流,血流を介してペスト菌が全身播種し,敗血症型ペストに移行する場合もある.通例,発症後3 ~4 日経過後に急激なショック症状,昏睡,手足の壊死,紫斑など敗血症を呈し2~3日以内に死亡する.また,稀に眼などの臓器でも化膿性潰瘍や出血性炎症を形成する場合があり,眼ペストと呼ぶこともある.
3)肺ペスト
最も危険なタイプである.腺ペスト末期,敗血症型ペストの経過中に肺に菌が侵入して肺炎を続発する場合がある.このとき肺では,肺胞が壊れており,患者はペスト菌を含んだ気道分泌液(血痰など)を排出するようになる.この患者が感染源となり,ヒト-ヒト間で飛沫感染が起こる.経気道感染の場合の潜伏期間は通例2~3日であるが,最短12~15時間という例もある.肺ペスト発病後は通常24時間以内に死亡すると言われる.臨床症状としては,強烈な頭痛,嘔吐,40℃前後の高熱,急激な呼吸困難,鮮紅色の泡立った血痰を伴う重篤な肺炎像を示す.
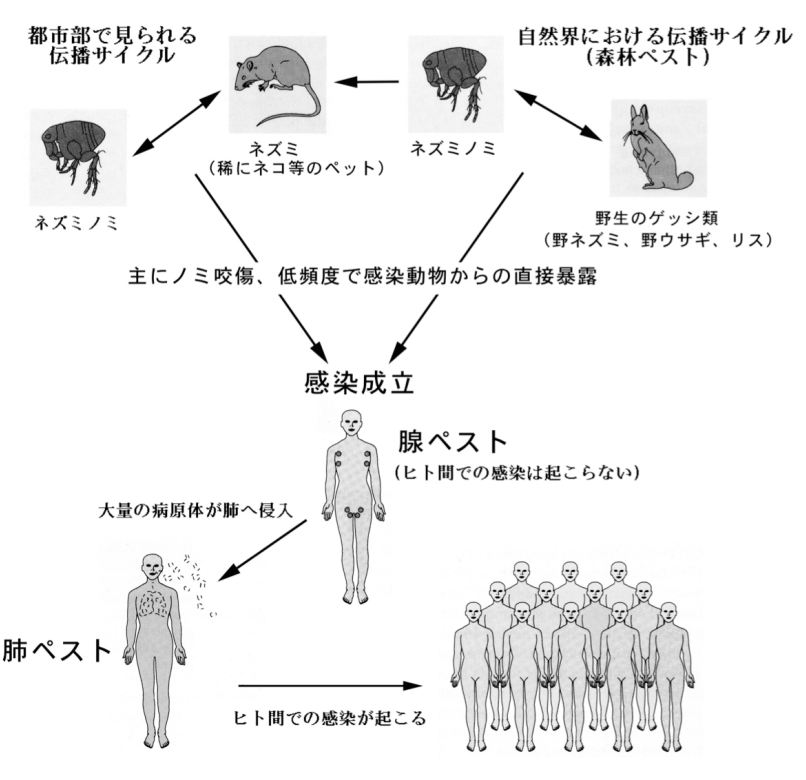
感染経路(図1)
1) ノミによる感染
ペスト菌は主に野生ゲッ歯類などの小動物などを感染動物とし,これを吸血するノミを媒介節足動物とする伝播サイクルにより自然界において維持伝播されている.ヒトはこのサイクル中に入り込むことによってペスト菌への感染が成立する.ヒトに対してペスト菌を伝播する主な媒介節足動物は,ネズミノミ属の一種 Xenopsylla cheopis (一般名:東洋ネズミノミ)である[1].この他,Xenopsylla astia やXenopsylla brasiliensisなどのネズミノミ属のノミ,ならびにSynopsyllus fonquernieiやOropsylla silantiewiなどのノミもペスト菌の伝播に関与しているとされる[2,3].
アメリカにおける1970年以降のペストに関する疫学調査では,ヒトへのペスト菌感染経路は病原体保有ノミ刺咬に基づく感染(78%),およびペットなどを含む感染小動物の体液,組織からの感染(20%)がほとんどであったことが示されている.アメリカでは野生のリス,ウサギ,プレイリードッグ,ネズミなどが感染宿主である,もしくは感染ノミを付着させていたことが報告されている.このため,これら野生動物を狩猟するヒトは高リスク集団に含まれる.モンゴルや中国では,野生マーモットの猟師で集団感染が報告されているが,これはマーモットに外部寄生するノミを介した感染であると考えられている[4].
2) 接触感染
感染動物の体液やその組織からの接触感染が知られている.ネコはペスト菌に感染,発症することが知られているが,これはネコが保菌ネズミ等を捕食する際に,保菌ノミに曝露され感染するためと考えられている(稀に経口的に感染した例も報告がある)[5,6].
一方,一般的にイヌはペスト菌に低感受性であると考えられていたが[4] ,2014年に飼育犬を感染源とする小規模のヒト肺ペスト流行が報告された[7].流行地域への渡航者は,自身の感染予防のため,野生動物等との接触に加え愛玩動物との過度の接触にも留意すべきであろう.
ジビエ食がペスト感染の原因となった例は限られている.サウジアラビアでは,ペスト菌に感染したラクダの肝臓を生食したことにより,ペスト菌による咽頭炎を発症した例が報告されている[8].2019年にモンゴルにおいても,ジビエ食(マーモット内蔵の非加熱摂食)によるペスト菌感染が報道されたが[9],直接の因果関係は明らかになっていない.
(3) 飛沫感染
肺ペスト患者,動物からの飛沫感染が感染拡大につながることがある.特に, 肺ペスト症状が進行し菌を含んだ気道分泌液を排出するようになった状態や,肺ペストの治療開始後においても,抗菌薬による治療が十分ではない間(治療開始後,48時間程度)は二次感染に対する予防策が必要である[10,11].20世紀初頭,StrongとTeagueは,肺ペスト患者からのペスト菌を含んだ血痰などが,1〜2メートルは飛散することを実験的に示している[12].また,アメリカにおいては,1977年-1998年の間に報告された感染ネコからの感染事例のうち,肺ペストを発症したネコからの飛沫感染と考えられる事例が5例報告されている[6].
 |
|
図 1.ペスト菌の感染経路.(出典:Mims C. et al. Plague. Medical Microbiology 2nd Ed. pp 372-375.より改変. |
ペスト患者からの感染性期間[18]
腺ペスト患者の病変リンパ節の膿分泌物,および肺ペスト患者の呼吸器分泌物は病原体を含み感染性がある[23].後者については,通常は病状が進行し,血痰を伴うような場合に感染性が高いとされる[24].また,有効な抗菌薬の投与を開始後 48 時間が経過し,かつ,喀痰の量が顕著に減少するなど,臨床的な改善が見られた場合は,気道分泌液を介した感染のリスクは低下する[11, 25].死亡直後のペスト患者血液・体液も感染性がある.他方,無症候性病原体保有者(咽頭保菌者など)からの感染性を示す証拠はない.
疫 学
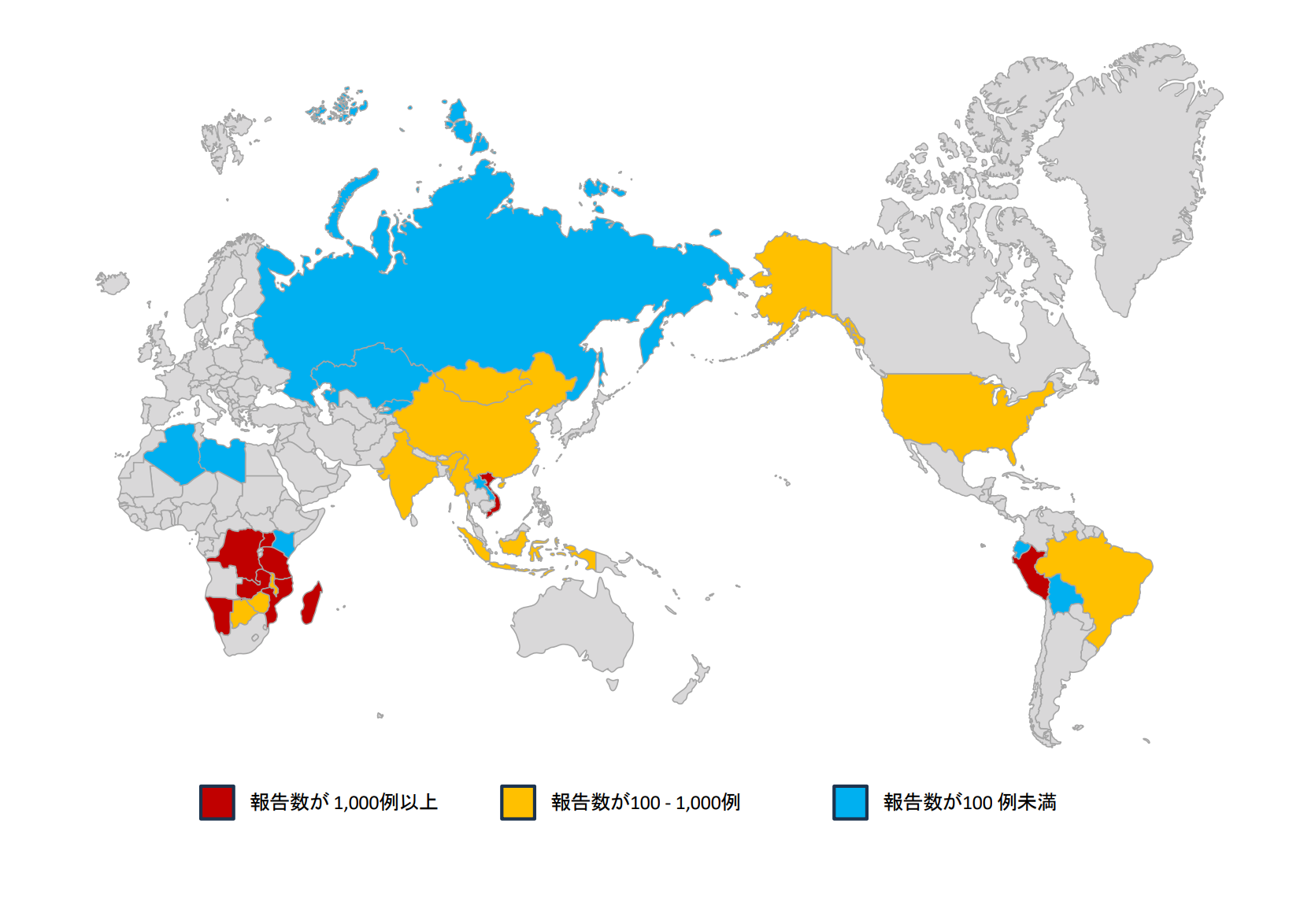
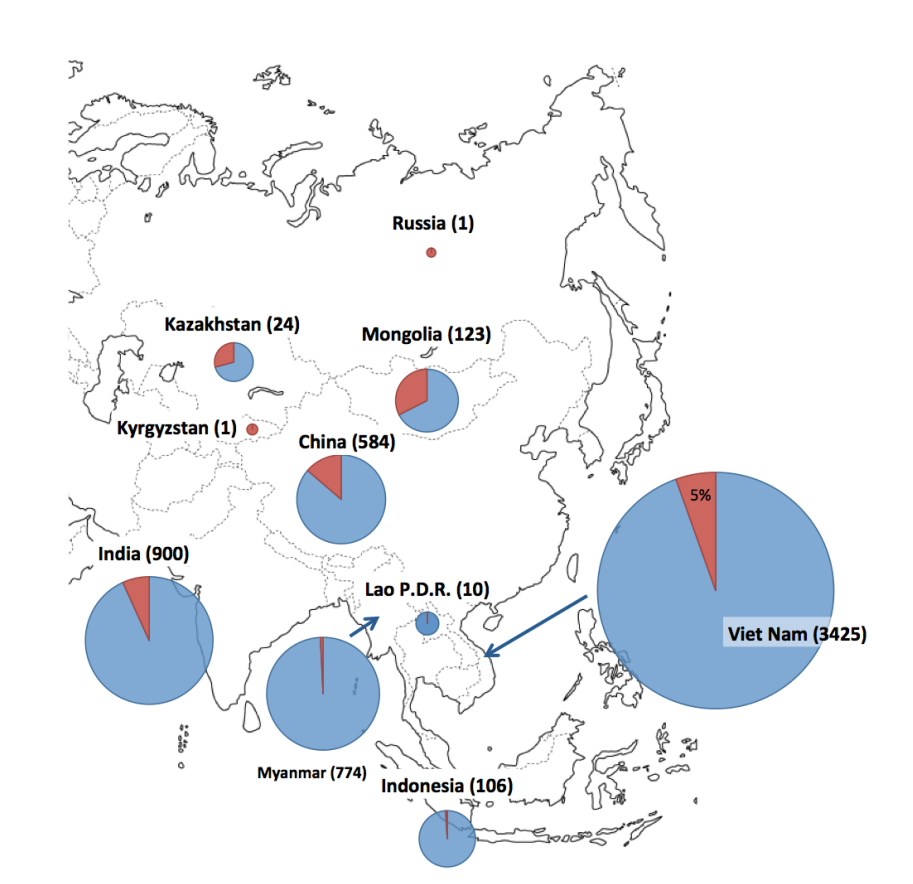
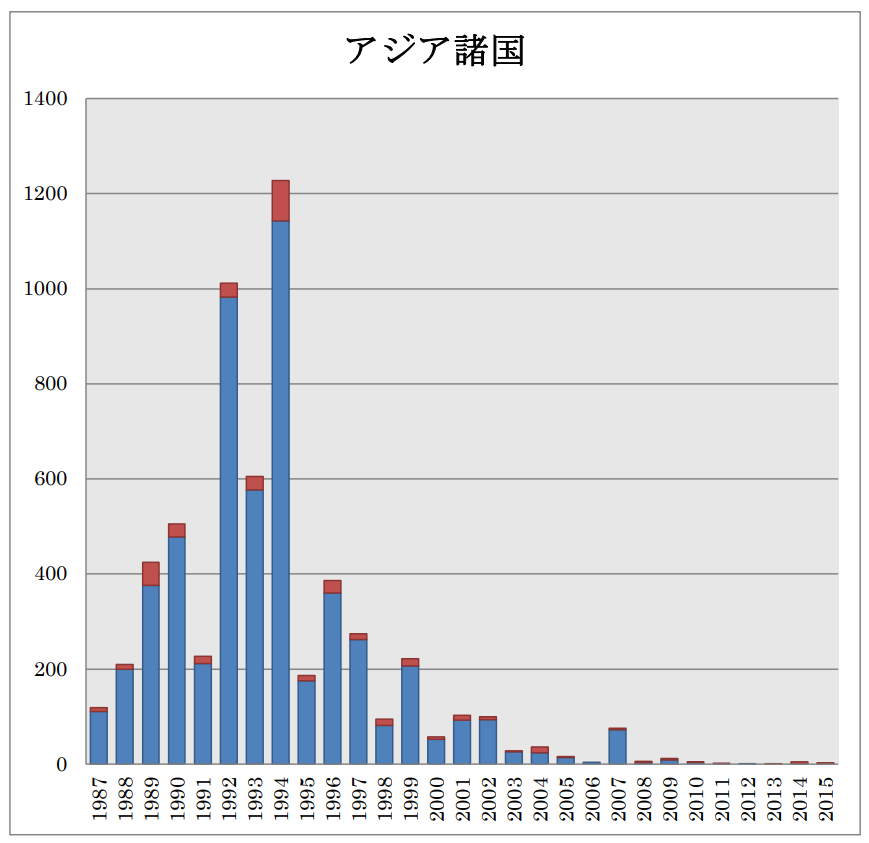
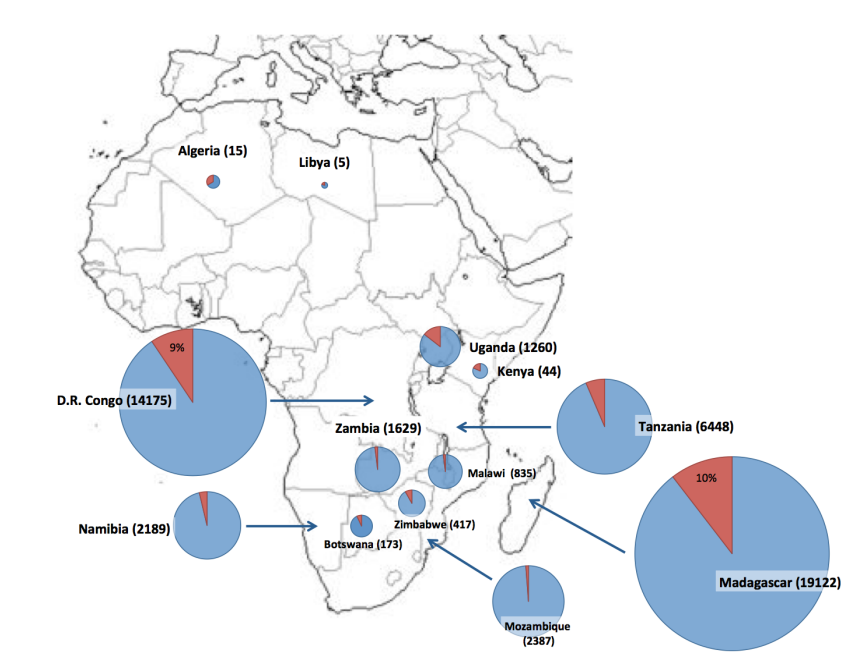
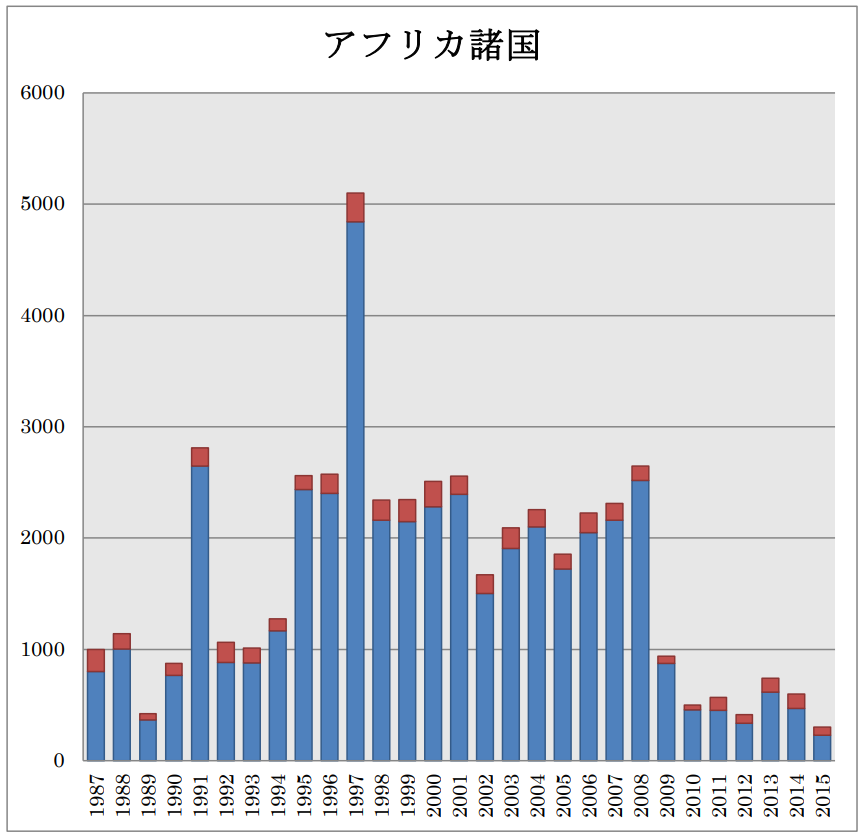
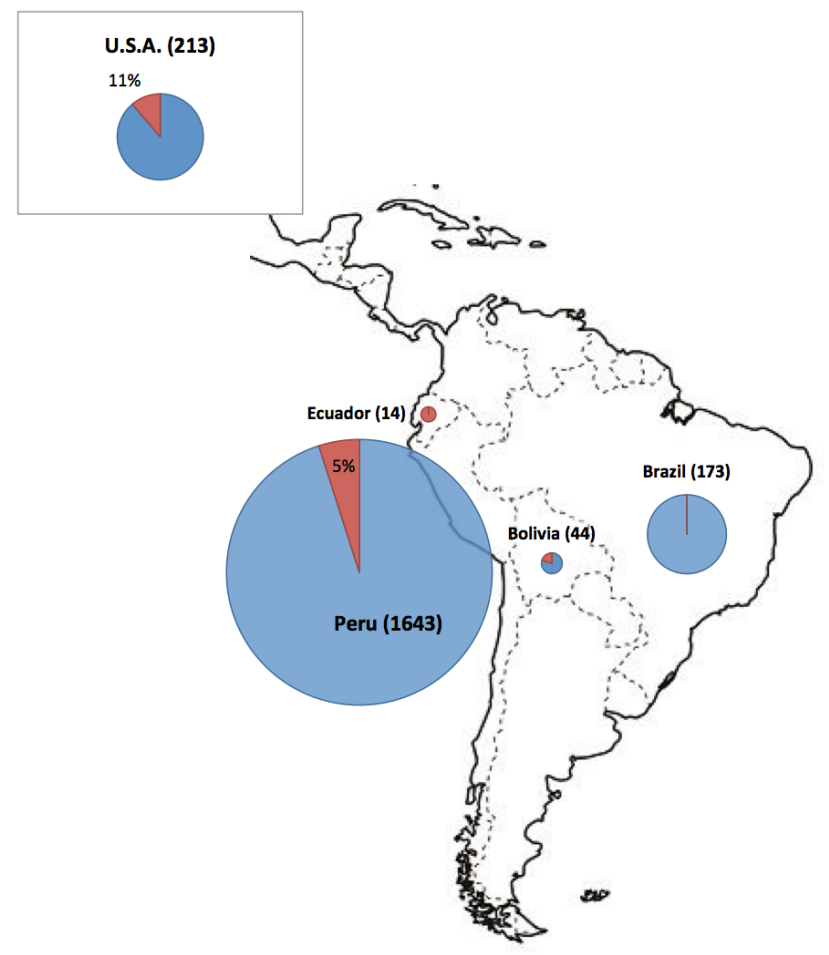
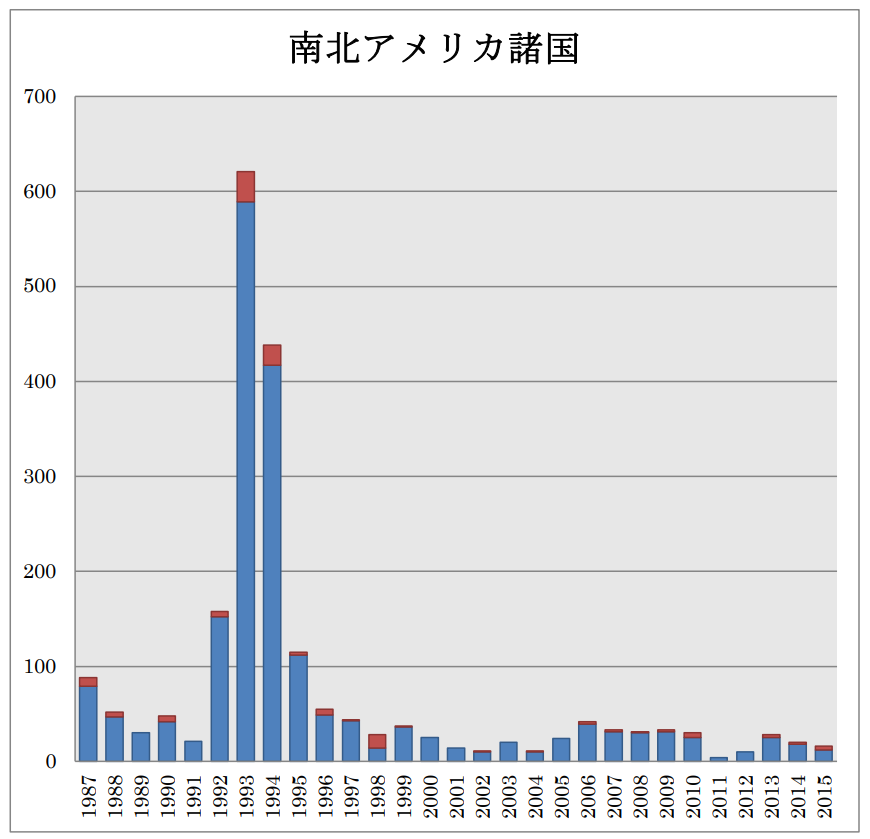
21世紀以降は,主にアフリカ,南北アメリカ,アジアで患者が報告されている[13,14].WHOによれば, 2004-2015年の12年間で,全世界で56,734名の患者が発生し,死亡者数は4,651名(死亡率 8.2%)であったとされる.これら患者の86%(48,699名)は,マダガスカル(19,122名),コンゴ民主共和国(14,175名),タンザニア(6,448名)を含むアフリカ諸国で報告されている.南北アメリカ諸国では,1992-1995年に流行があったペルーの他,米国,ボリビアで現在も散発事例が報告されている.ロシアを含むアジア地域ではベトナム(3,425名),インド(900名),ミャンマー(774名),中国(584名)などで患者が報告されているが,直近の2011-2015の5年間では,中国(5名),モンゴル(5名),キルギスタン(1名),ロシア(1名)であり,報告された数の上では,稀な感染症となってきている.WHOが示した世界におけるペストの過去の患者発生状況(1987-2015年)を図2-5に各々示した[14].
 |
|
図2.WHOが示した世界における過去の患者発生状況(1987-2015年)[14] |
 |
 |
|
図 3A.アジア諸国における患者報告数.1987-2015 年の累積報告数を国名に続き記載した。円グラフ中の赤は患者報告数に占める死亡者数の割合を示している. |
図 3Bアジア諸国における患者報告数の年別推移.棒グラフ中の赤は患者報告数に占める死亡者数を示している. |
 |
 |
|
図 4A.アフリカ諸国における患者報告数.1987-2015 年の累積報告数を国名に続き記載した。円グラフ中の赤は患者報告数に占める死亡者数の割合を示している. |
図 4B.アフリカ諸国における患者報告数の年別推移.棒グラフ中の赤は患者報告数に占める死亡者数を示している. |
 |
 |
|
図 5A.南北アメリカ諸国における患者報告数.1987-2015 年の累積報告数を国名に続き記載した。円グラフ中の赤は患者報告数に占める死亡者数の割合を示している.北アメリカ大陸においてペスト患者が報告されている国は米国のみである. |
図 5B.アフリカ諸国における患者報告数の年別推移.棒グラフ中の赤は患者報告数に占める死亡者数を示している. |
この他,マダガスカルでは,2017年8月に肺ペスト患者が報告された後,11月までの4ヶ月に渡ってペストの流行が続いた.この間の患者数は2,348名(治療等に従事した医療関係者81名を含む)で,死亡例が202例であった.臨床的に肺ペストと診断された患者数は1,791名であり[15],ヒト-ヒト間の飛沫感染が感染拡大の一因であったと考えられている.
我が国においても,過去に大規模な流行があったことが記録されている.1899年にペストが日本に侵入してから1926年までの27年間に大小の流行が起こり,感染例2,905名(内,死亡例2,420名 )が報告された.他方,1927年以降,国内感染例の報告はないことから,現在では国内でのペスト菌感染の可能性は極めて低いと考えられている.
病原体
全ゲノム配列の解析から,ペスト菌は約6,000年前に仮性結核菌(Yersinia pseudotuberculosis) serotype O:1b から進化した菌で,ゲノム内では多数の他の細菌やウイルス遺伝子の組換えが頻繁に繰り返された痕跡や,腸管病原性をもつ菌であったと推定されるペスト菌と仮性結核菌との共通祖先からの進化の過程で不要になった,腸管病原性に関与する遺伝子(約150個)の不活化が示されたことなど,ゲノムの大規模な変動を経て,極めて毒性の強い菌に進化したことが明らかになった.ペスト菌は約4.65 Mb の染色体DNAと,9.6 kb,70 kb,96.2 kb の3 種類のビルレントプラスミドから構成されている.9.6 kb プラスミドにはプラスミノーゲンアクチベーター,ペスチシン1 ,コアグラーゼが,70kbp プラスミドにはYersinia の外膜蛋白(Yops)が,96.2kb プラスミドには莢膜抗原(通称,Fraction 1(F1)抗原),murine toxin がコードされている.ペスト菌は非運動性のグラム陰性の多形形態を示すが,組織内および培養菌などの新鮮な菌では,約1.5 ×0.7μm の両端の丸い楕円形の短桿菌で,単染色法では特徴ある明瞭な極小体が観察される.発育適温は28~30℃で,1~45 ℃で発育する.ペスト菌の特徴ある形態学的性質(莢膜抗原)の発現には37℃が適している.その発育は他の一般的な菌よりも遅く,血液寒天,BHI寒天,CIN寒天培地などによる培養においても集落が明らかに認められるのは48 時間培養後である.また血液寒天培地上での溶血像は見られない.また,ペスト菌は環境中では不安定であり,長期間生存できないとされる.
病原診断
1) 疑似患者
(1) ペスト流行地への渡航歴や,バイオテロに巻き込まれた可能性がある場合で,ペストの臨床症状を示し,さらに,臨床材料からグラム陰性で両端染色性を示す桿菌や,診断用抗原(莢膜抗原)に対する抗体に対して陽性を示す菌が検出された場合
(2) ペスト菌に特異的なプライマーを用いたPCR 法で,特異的なバンドが検出された場合
(3) 患者血清中の抗Fraction 1 抗体価が,passive haemagglutination test等で16 倍以上を示した場合
2) 確定患者
(1) 臨床材料から分離した菌が,ペスト菌と同定された場合.この場合,顕微鏡所見で明らかな極小体を示すグラム陰性桿菌で,莢膜抗原に対する抗体に陽性を示すこと,ペスト菌に特異的なDNAプライマーを用いたPCR 法で陽性を示すこと,ペスト菌に特異的なバクテリオファージに対して感受性を示すこと,生化学的性状がペスト菌の性状と一致すること,などから総合的に判断する.
(2) Passive haemagglutination test 等で,診断用抗原に対する回復期の抗体価が,感染初期の抗体価に対し4倍以上,上昇している場合.
なお,自動細菌同定装置による分離菌同定により,ペスト菌がAcinetobacter lwoffii, もしくはPseudomonas luteolaと誤同定された例が報告されている[16,17].このことから,実際のペスト確定にはペスト菌が培養され,その菌が必要かつ十分な検査法でペスト菌であることを示す事が重要と考えられる[18].
治 療
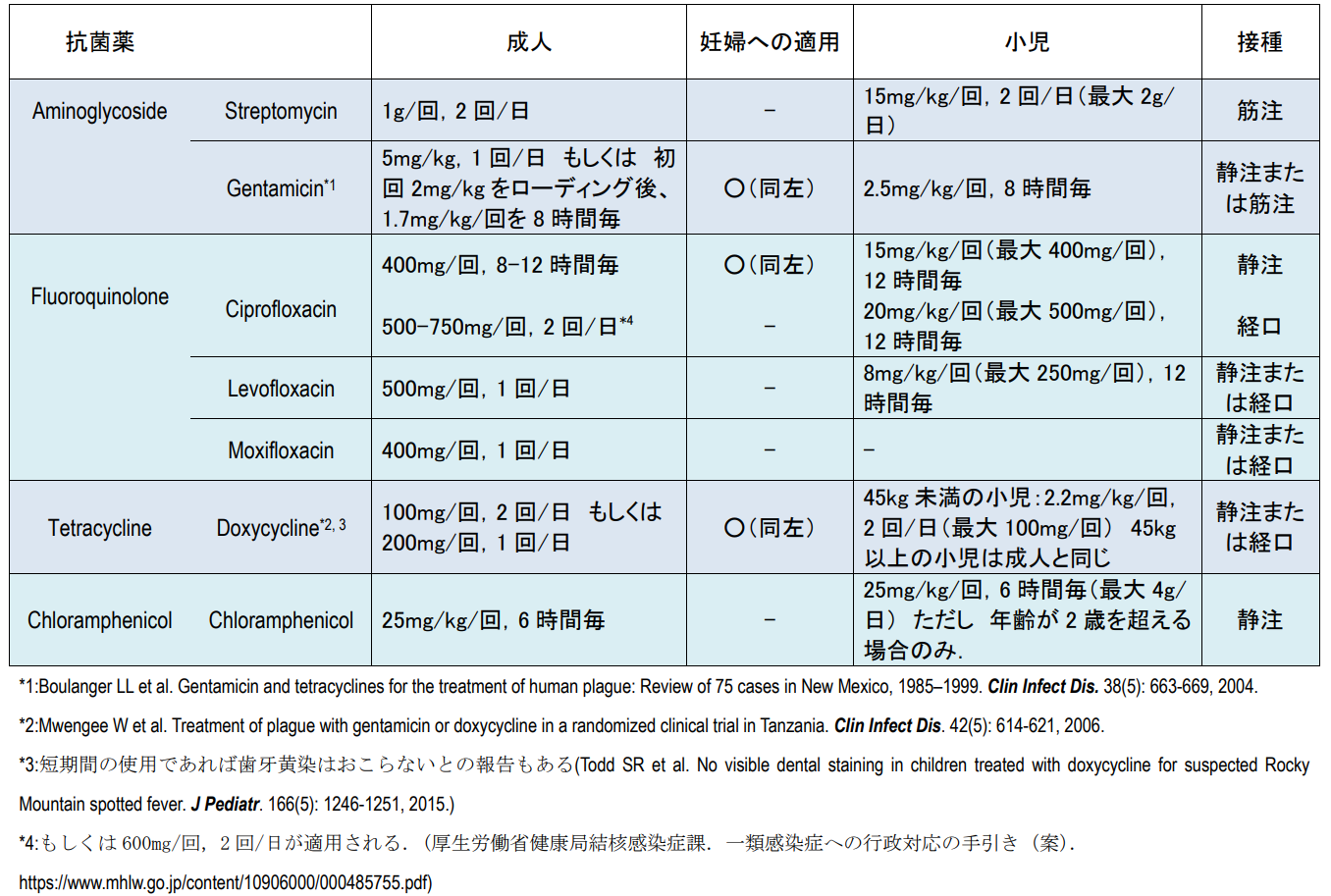
抗菌療法と全身管理が治療の中心である.日本でペスト菌が適応菌種として承認されているのは,ストレプトマイシン,ドキシサイクリン,レボフロキサシンである[18].肺ペストの場合は病気の進行が極めて速いので,特に抗菌薬の早期の投与が必須である.有効な抗菌薬が投与されると,通常 72 時間内に解熱することが多い.ほとんどの場合,予後は良好である.発症後の治療では,即効性が高い静脈内投薬が推奨されている.標準的な投薬期間は10-14日間,もしくは解熱後2日間までとされている.ペスト菌の薬剤耐性は稀であり,既存の抗菌薬で治療困難な耐性菌の存在は知られていない.なお,生物テロでペスト菌が使用される場合には,人為的に薬剤耐性化させている可能性が高い.このため,アミノグリコシド系,フルオロキノロン系,テトラサイクロン系の他,クロラムフェニコールなどから系統の異なる2剤以上を併用することが検討される[18].また,米国 FDA はシプロフロキサシンとレボフロキサシンをペストの治療薬として承認している.この他にクロラムフェニコールも選択肢となる.表1に,米国CDCが推奨する治療薬の一覧を参考として示した[19,20,21].
| 表1.ペストの治療に用いられる抗菌薬 (https://www.cdc.gov/plague/healthcare/clinicians.html) |
予 防
1) 予防行動
ペスト常在地に渡航する旅行者は,ネズミやノミとの接触を避けるよう注意する.節足動物に対する忌避薬(DEETなど)の使用は,蚊やダニ刺咬による感染症を予防する上でも推奨される.肺ペスト患者と接する場合は、飛沫感染に対する標準的な予防策を講ずる[25,26].
2) 抗菌薬の予防投与
ペスト菌を含んだ患者血液・体液の曝露があった場合(肺ペスト患者への気管内操作時のエアロゾルの吸引,血液・リンパ節穿刺に伴う針刺しなどの血液・体液曝露,検査室での培養検体からの曝露など)には,発症を予防するために抗菌薬の内服が推奨される.抗菌薬の予防的投薬はいずれも経口で最終曝露から7日間投与する(表2).妊婦では有益性が危険性を上回ると判断される場合にのみ投与する[18].
3) ワクチン
2023年時点、国内で接種可能なワクチンはない.次世代のワクチンが開発中である[22].
|
表2.曝露後の予防投薬(ペスト) (https://www.cdc.gov/plague/healthcare/clinicians.html) |
感染症法における取り扱い (2023年9月現在)
全数報告対象(1類感染症 )であり,診断した医師は直ちに最寄りの保健所に届け出なければならない.
届出基準はこちら
学校保健安全法における取り扱い (2023年9月現在)
第1種の感染症に定められており,治癒するまで出席停止とされている.
また,以下の場合も出席停止期間となる.
・患者のある家に居住する者又はかかっている疑いがある者については,予防処置の施行の状況その他の事情により学校医その他の医師において感染のおそれがないと認めるまで.
・発生した地域から通学する者については,その発生状況により必要と認めたとき,学校医の意見を聞いて適当と認める期間
・流行地を旅行した者については,その状況により必要と認めたとき,学校医の意見を聞いて適当と認める期間
【参考文献】
[1] Perry RD and Fetherston JD. Yersinia pestis—Etiologic Agent of Plague. Clin Microbiol Rev. 10(1): 35-66, 1997.
[2] Andrianaivoarimanana V. et al. Understanding the Persistence of Plague Foci in Madagascar. PLoS Neglect Trop Med. 7(11): e2382, 2013.
[3] Galdan B et al. Plague in Mongolia. Vector Borne Zoonotic Dis. 10(1): 69-75, 2010.
[4] Butler T. Plague into the 21st century. Clin. Infect. Dis. 49: 736-742, 2009.
[5] Eidson M, etal. Feline plague in New Mexico: risk factors and transmission to humans. Am J Public Health. 78:1333–1335, 1998.
[6] Gage KL, at al. Cases of cat-associated human plague in the Western US, 1977-1998. Clin. Infect. Dis. 30: 893-900, 2000.
[7] Runfola JK et al. Outbreak of Human Pneumonic Plague with Dog-to-Human and Possible Human-to-Human Transmission--Colorado, June-July 2014. MMWR 64(16): 429-434, 2015.
[8] Bin Saeed AA et al. Plague from eating raw camel liver. Emerg Infect Dis. 11(9):1456-1457, 2005.
[9] Mongolian couple die of bubonic plague after eating marmot. https://www.theguardian.com/world/2019/may/06/mongolian-couple-die-of-bubonic-plague-after-eating-marmot
[10] APIC Bioterrorism Task Force and CDC Hospital Infections Program Bioterrorism Working Group. Bioterrorism readiness plan: A template for healthcare facilities. Available at: https://emergency.cdc.gov/bioterrorism/pdf/13apr99APIC-CDCBioterrorism.pdf (Accessed Nov 6, 2019.)
[11] Kool JL. Risk of person-to-person transmission of pneumonic plague. Clin Infect Dis. 40: 1166-1172, 2005.
[12] Strong RP and Teague O. Studies on pneumonic plague and plague immunization. Philippine J. Sci. 8: 129-268, 1912.
[13] Bertherat E. Plague around the world, 2010-2015. Weekly epidemiological record, WHO. 91(8), 89-92, 2016.
[14] WHO. Human plague: review of regional morbidity and mortality, 2004-2009. Weekly epidemiological record, WHO. 82(6), 40-45, 2010.
[15] WHO. Plague – Madagascar. Diseases Outbreak News. Available at: https://www.who.int/csr/don/27-november-2017-plague-madagascar/en/ (Accessed Nov 6, 2019.)
[16] Tourdjman M, et al. Misidentification of Yersinia pestis by automated systems, resulting in delayed diagnoses of human plague infections—Oregon and New Mexico, 2010–2011. Clin Infect Dis. 55:e58–60, 2012.
[17] Centers for Disease Control and Prevention (CDC) Notes from the field: two cases of human plague—Oregon, 2010. MMWR Morb Mortal Wkly Rep. 60:214, 2011.
[18] 厚生労働省健康局結核感染症課.一類感染症への行政対応の手引き.(案).https://www.mhlw.go.jp/content/10906000/000485755.pdf
[19] CDC. Plague.https://www.cdc.gov/plague/healthcare/clinicians.html
[20] Boulanger LL et al. Gentamicin and tetracyclines for the treatment of human plague: Review of 75 cases in New Mexico, 1985–1999. Clin Infect Dis. 38(5): 663-669, 2004.
[21] Mwengee W et al. Treatment of plague with gentamicin or doxycycline in a randomized clinical trial in Tanzania. Clin Infect Dis. 42(5): 614-621, 2006.
[22] https://www.who.int/blueprint/what/norms-standards/PlagueVxeval_FinalMeetingReport.pdf
[23] Bertherat K, and Gage K. Plague. Control of communicable diseases. 20th Ed. (Heymann DJ. Ed) pp456-465, 2014.
[24] Nelson CA, et al. Antimicrobial Treatment and Prophylaxis of Plague: Recommendations for Naturally Acquired Infections and Bioterrorism Response. MMWR Recomm Rep. 70(3): 1–27, 2021.
[25] Inglesby TV, Dennis DT, Henderson DA, et al. Plague as a biological weapon: medical and public health management. JAMA 283:2281–2290, 2000.
[26] https://www.who.int/news-room/fact-sheets/detail/plague (Accessed Sep 5, 2023.)