お知らせ
感染症情報
研究・検査・病原体管理
サーベイランス
刊行・マニュアル・基準
- 詳細
2012年第33週(第33号) *7月報含む
(8月13日~8月19日)発生動向総覧 /注目すべき感染症(ペニシリン耐性肺炎球菌感染症)/病原体情報(無菌性髄膜炎患者から検出されているウイルス 2012年)/速報(フィリピンから帰国後に発症し確認されたチクングニア熱輸入症例-千葉県)/海外感染症情報(コンゴ民主共和国でエボラ出血熱が発生しています/シエラレオネでコレラが流行しています/アフリカのコレラの流行状況について) 〔2012年8月31日発行〕
- 詳細
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
〈第32週コメント〉 8月15日集計分 ◆全数報告の感染症 注意:これは当該週に診断された報告症例の集計です。しかし、迅速に情報還元するために期日を決めて集計を行いますので、当該週に診断された症例の報告が集計の期日以降に届くこともあります。それらについては一部を除いて発生動向総覧では扱いませんが、翌週あるいはそれ以降に、巻末の表の累積数に加えられることになります。 *感染経路、感染原因、感染地域については、確定あるいは推定として記載されていたものを示します。
全国の指定された医療機関(定点)から報告され、疾患により小児科定点(約3,000 カ所)、インフルエンザ(小児科・内科)定点(約5,000 カ所)、眼科定点(約600 カ所)、基幹定点(約500 カ所)に分かれています。また、定点当たり報告数は、報告数/定点医療機関数です。
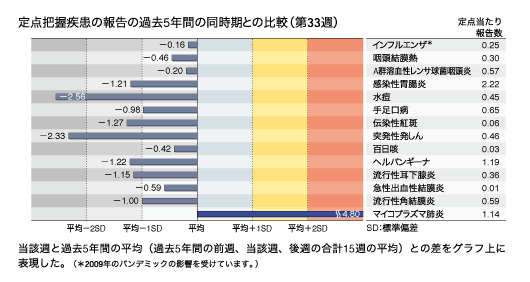
基幹定点報告疾患:マイコプラズマ肺炎の定点当たり報告数は増加し、過去5年間の同時期(前週、当該週、後週)と比較してかなり多い。都道府県別では群馬県(5.00)、栃木県(4.86)、愛知県(2.92)が多い。
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
- 詳細
2012年第32週(第32号)
(8月6日~8月12日)発生動向総覧/注目すべき感染症(腸管出血性大腸菌感染症)/病原体情報(手足口病患者から検出されているウイルス 2012年)/速報(チクングニア熱のカンボジアからの輸入例-福岡市)/海外感染症情報(シエラレオネでコレラが流行しています/ウガンダでエボラ出血熱が発生しています/ コンゴ民主共和国でエボラ出血熱が発生しています/インフルエンザ ) 〔2012年8月24日発行〕
- 詳細
溶血性レンサ球菌レファレンスセンター
(IASR Vol. 33 p. 211-212: 2012年8月号)
溶血性レンサ球菌レファレンスセンターは、8つのセンター(福島県衛生研究所、富山県衛生研究所、東京都健康安全研究センター、神奈川県衛生研究所、大阪府立公衆衛生研究所、山口県環境保健センター、大分県衛生環境研究センター、国立感染症研究所)(表1)が中心となって、国内で発生した溶血性レンサ球菌感染症患者から分離された菌株にかかわるレファレンス活動を行っている。主な検査として、咽頭炎由来株および劇症型溶血性レンサ球菌感染症由来株の血清型別、遺伝子型別、薬剤感受性試験である。
血清型別:A群溶血性レンサ球菌の菌体表層には、MおよびT蛋白等が存在しており、血清型別に利用されている。M蛋白は、耐熱性、トリプシン感受性、型特異的であり、100以上の型が知られている(http://www.cdc.gov/ncidod/biotech/strep/strepindex.htm)。M蛋白は、抗オプソニン作用を有し、細胞への接着にも関与しており、病原因子として知られている。分離株のM型別を行うことは病因との関連を知る上で重要であるが、継代による蛋白の脱落が生じることや、市販血清がないことから、M型別の実施は困難であり、一部の機関でのみ行われている。近年、M型別を血清学的方法ではなく、M蛋白遺伝子(emm )の領域を明らかにし、型別する試みもなされている。一方、T蛋白は病原性と無関係とされているが、T型別とM型別の菌型は相対すること(表2)、トリプシン耐性、型特異的、M蛋白に比べ安定性があり、さらに、継代に耐えうることから、疫学調査の手段として用いられ、多くの施設で実施されている。
遺伝子型別:A群溶血性レンサ球菌の多型性あるいは毒素遺伝子の保有を知る方法として、emm 遺伝子型別とspe 遺伝子型別がある。emm 遺伝子型別は、前述したM型別を血清学的方法ではなく、M蛋白をコードする遺伝子の領域を明らかにし、型別する方法である。M蛋白はemm 遺伝子1遺伝子によってコードされていることから、このemm 遺伝子をPCRで増幅後、その増幅産物の塩基配列を決定することで、emm 遺伝子型を同定することができる。現在まで、100以上の型が同定されている。また、このemm 遺伝子は、Streptococcus pyogenes ばかりでなく、S. dysgalactiae subsp. equisimilis でも保有している。発赤毒素(streptococcal pyrogenic exotoxin: SPE、あるいは、erythrogenic toxin: ET、Dick toxin)は、猩紅熱患者から分離されたA群溶血性レンサ球菌株の培養濾液中に存在する病原因子として1924年Dickにより発見された。主なSPEとしては、SPE-A、SPE-B、SPE-Cがあり、それぞれの遺伝子(speA , speB , speC )に特異的なプライマーを準備することにより、PCR法で簡便に遺伝子保有の有無を調べることができる。
薬剤感受性試験:薬剤感受性試験は、CLSI(旧NCCLS 米国臨床検査標準委員会)に基づく微量液体希釈法により、MIC(最小発育阻止濃度)を測定している。劇症型溶血性レンサ球菌感染症由来株は、アンピシリン(ABPC)、ペニシリンG(PCG)、セファゾリン(CEZ)、セフォタキシム(CTX)、メロペネム(MEPM)、イミペネム(IPM)、パニペネム(PAPM)、エリスロマイシン(EM)、クリンダマイシン(CLDM)、リネゾリド(LZD)、シプロフロキサシン(CPFX)、ミノサイクリン(MINO)計12薬剤について検査をしている。咽頭炎由来株は、アンピシリン(ABPC)、セフジニル(CFDN)、セファレキシン(CEX)、セフジトレン(CDTR)、エリスロマイシン(EM)、クラリスロマイシン(CAM)、リンコマイシン(LCM)、クリンダマイシン(CLDM)、テトラサイクリン(TC)、クロラムフェニコール(CP)計10薬剤について検査をしている。
近年、薬剤耐性株の急増傾向が明らかとなってきている。しかしながら、迅速診断キットの普及により、菌株の収集が減少しており、薬剤耐性率の十分な把握には至っていないのが現状である。今後、薬剤耐性のモニタリングの全国規模での実施が望まれる。
衛生微生物技術協議会溶血性レンサ球菌レファレンスセンター
福島県衛生研究所
富山県衛生研究所
東京都健康安全研究センター
神奈川県衛生研究所
大阪府立公衆衛生研究所
山口県環境保健センター
大分県衛生環境研究センター
国立感染症研究所
- 詳細
劇症型/重症溶血性レンサ球菌感染症患者分離株のemm 遺伝子型、2006~2011年
(IASR Vol. 33 p. 212-213: 2012年8月号)
A群レンサ球菌には、数多くの表層抗原因子が知られている。このうちM蛋白質は型特異的であり、100以上の型が知られていることから、菌の疫学マーカーとしてよく用いられている。M蛋白は、抗オプソニン作用を有し、細胞への接着にも関与しており、病原因子として知られている。分離株のM型別を行うことは病因との関連を知る上で重要である。M型別を血清学的方法ではなく、M蛋白をコードする遺伝子(emm )の塩基配列を決定することで、遺伝子による型別が可能となった。
2006~2011年までに衛生微生物技術協議会溶血性レンサ球菌レファレンスセンター(本号3ページ参照)に集められた劇症型A群レンサ球菌感染症患者分離株311株(2006年41株、2007年43株、2008年36株、2009年52株、2010年59株、2011年80株)について、emm 遺伝子型を調べた。311株のうち、307株がStreptococcus pyogenes 、4株がS. dysgalactiae subsp. equisimilis であった。全部で27種類のemm 遺伝子型の株が2006~2011年の間に分離された(図1)。最も多い型は、emm1 型で、54%(167株)を占める。続いて、emm28 (7.4%、23株)、emm89 (6.8%、21株)、emm3 (6.4%、20株)、emm12 (6.4%、20株)と続いていた。最も多かったemm1 型は、毎年最も多く分離された遺伝子型であり、2010年以降、分離比率が増加傾向にある(2009年40%; 2010年58%; 2011年70%)。S. dysgalactiae subsp. equisimilis と同定された分離株のemm 遺伝子型は、stG245 とstG485 であった。
G群レンサ球菌もA群同様emm 遺伝子を保有しており、emm 遺伝子型別が可能である。2006~2011年までに衛生微生物技術協議会溶血性レンサ球菌レファレンスセンターに集められた劇症型G群レンサ球菌感染症患者分離株69株(2006年9株、2007年2株、2008年7株、2009年12株、2010年17株、2011年22株)について、emm 遺伝子型を調べた(図2)。69株すべてS. dysgalactiae subsp. equisimilis であった。全部で13種類のemm 遺伝子型の株が2006~2011年に分離された。最も多い型は、stG6792 型で、26%(18株)を占めた。続いて、stG485 (12%、8株)、stG245 (10%、7株)、stG2078 (10%、7株)と続いていた。A群と異なり、最も多く分離されたemm 型は毎年異なっている(2006年 stG485 、2007年 stG652 、stG2078 、2008年 stG245 、2009年 stG6792 、2010年 stG6792 、2011年 stG245 、stG652 、stG6792 )。
A群レンサ球菌やG群レンサ球菌による劇症型溶血性レンサ球菌感染症が近年増加していることから、どのような遺伝子型を示す株がこの感染症を引き起こしているか把握するためにも、さらなる調査が必要である。
国立感染症研究所 池辺忠義 大西 真
大分県衛生環境研究センター 緒方喜久代
山口県環境保健センター 富永 潔
大阪府立公衆衛生研究所 勝川千尋
神奈川県衛生研究所 大屋日登美
東京都健康安全研究センター 奥野ルミ
富山県衛生研究所 嶋 智子
福島県衛生研究所 千葉一樹
- 詳細
2006~2011年に分離された劇症型/重症溶血性レンサ球菌感染症患者由来株の薬剤感受性
(IASR Vol. 33 p. 213-214: 2012年8月号)
劇症型溶血性レンサ球菌感染症(streptococcal toxic shock syndrome: STSS)は、病状の進行が急激かつ劇的で、発病から数10時間以内にショック症状、急性腎不全、成人型呼吸窮迫症候群、多臓器不全、壊死性筋膜炎などを伴う、致死率の高い重篤な感染症である。STSSの治療には、抗菌薬として、ペニシリン系薬剤とクリンダマイシンの大量投与が推奨されている。2006~2011年に分離されたSTSS株311株について薬剤感受性試験を行った。2006~2011年の期間、311株のSTSS株が、溶血性レンサ球菌レファレンスセンターを通じて集められた。薬剤感受性試験は、ドライプレート(栄研化学)を用い、Clinical and Laboratory Standards Institute(CLSI)の方法に準拠し、ペニシリン系薬剤およびクリンダマイシンを含む11薬剤に対して判定を行った。PCRにより、エリスロマイシンおよびクリンダマイシン耐性株の耐性遺伝子(ermA 、ermB 、mefA )を検出した。
311株のすべてのSTSS患者分離株において、ペニシリン系薬剤であるアンピシリン、ペニシリンG、その他セファゾリン、セフォタキシム、イミペネム、パニペネム、リネゾリドの7つの薬剤に対して感受性を示した。一方、クリンダマイシンを含む4つの薬剤に対して非感受性株が毎年分離された。治療で推奨されているクリンダマイシンは、毎年5%前後の耐性株が分離されているが、2009年においてクリンダマイシン耐性株の分離比率が15%に増加した(図1)。90%以上のクリンダマイシン耐性株のemm 遺伝子型は、emm12 、emm28 、emm75 型であった。これらすべてのクリンダマイシン耐性株は、薬剤耐性遺伝子として、ermB 遺伝子を保有していた。また、エリスロマイシン耐性株も年々増加傾向にあり(図2)、その多くがemm1 であった。シプロフロキサシンやミノサイクリンに対しては10%前後の非感受性株が分離されていた。これら薬剤耐性株は、emm 型と関連性が高いことから、今後も薬剤耐性およびemm 遺伝子型の両面から動向を調査する必要がある。
国立感染症研究所 池辺忠義 大西 真
大分県衛生環境研究センター 緒方喜久代
山口県環境保健センター 富永 潔
大阪府立公衆衛生研究所 勝川千尋
神奈川県衛生研究所 大屋日登美
東京都健康安全研究センター 奥野ルミ
富山県衛生研究所 嶋 智子
福島県衛生研究所 千葉一樹