ブタの日本脳炎抗体保有状況 -2023年度速報-
|
速報一覧へ 戻る |
|
|
日本脳炎は、日本を含め東南アジアを中心に広く常在した疾患で、日本脳炎ウイルス(Japanese encephalitis virus: JEV)に感染した者のうち100~1,000人に1人程度が発症すると推定される重篤な急性脳炎である [1]。感染経路は、主にイエカ属の蚊(日本では主にコガタアカイエカ)による吸血でJEVに感染したブタ等を刺咬・吸血したのちにヒトを吸血することで感染する。 1960年代までは毎年夏から秋にかけて多数の日本脳炎患者が発生しており [2,3]、ブタの感染状況からJEVが蔓延している地域に多くの患者発生がみられた。1960年代の日本脳炎の患者が多数発生していた環境では、日本脳炎患者が検出される時期に先行してブタのJEVに対するHI抗体の上昇が確認されている [4]。1992年以降、日本脳炎患者の報告数は、2016年の11例、2019年の10例を除き全て一桁の報告でブタの感染状況と比較して患者発生数は低く、環境中のウイルス活動状況と必ずしも一致していない。しかし、ブタの抗体保有状況はウイルス陽性蚊の存在している地域を間接的に示唆するデータと推測され、少なくともこのような地域ではヒトへの感染リスクの存在する地域と考えられる。2015年には10か月齢の小児にも感染が確認され[5]、2022年は千葉県、広島県、熊本県から症例が報告されている。 感染症流行予測調査事業では、全国各地のブタ血清中のJEVに対する抗体保有状況を赤血球凝集抑制法(Hemagglutination inhibition test: HI法)により測定し、JEVの蔓延状況およびウイルスの活動状況を調査している。前年の秋以降に生まれたブタがJEVに対する抗体を保有し、さらに2-メルカプトエタノール(2-ME)感受性抗体(IgM抗体)を保有している場合、そのブタは最近JEVに感染したと考えられる。下表は本年度の調査期間中におけるブタの抗体保有状況を都道府県別に示しており、JEVに最近感染したブタが認められた地域を青色、それに加えて調査したブタの50%以上に抗体保有が認められた地域を黄色、80%以上に抗体保有が認められた地域を赤色で示している。 本速報はJEVの感染に対する注意を喚起するものである。それぞれの居住地域における日本脳炎に関する情報にも注意し、JEVが活動していると推測される地域においては、日本脳炎の予防接種を受けていない者、とくに乳幼児や高齢者は蚊に刺されないようにするなどの注意が必要である。 なお、日本脳炎定期予防接種は、第1期(接種回数は初回2回、追加1回)については生後6か月から90か月に至るまでの間にある者、第2期(1回)については9歳以上13歳未満の者が接種の対象であるが、平成7年4月2日(1995年4月2日)から平成19年4月1日(2007年4月1日)までに生まれた者で積極的勧奨の差し控えなどにより接種機会を逃した者は、20歳になるまでの間、定期接種として合計4回の日本脳炎ワクチンの接種が可能である(詳細は厚生労働省ページを参照)。また、平成19年4月2日(2007年4月2日)~平成21年10月1日(2009年10月1日)までに生まれた者に対しても、生後6か月から90か月未満のみならず9歳以上13歳未満の間にも、第1期(3回)の不足分を定期接種として接種可能である。ただし、生後90か月(7歳半)以上9歳未満は定期接種として接種することができないので、注意が必要である。市区町村からの案内に沿って接種を受けていただくようお願いしたい[6,7]。 |
抗体保有状況 (月別推移) 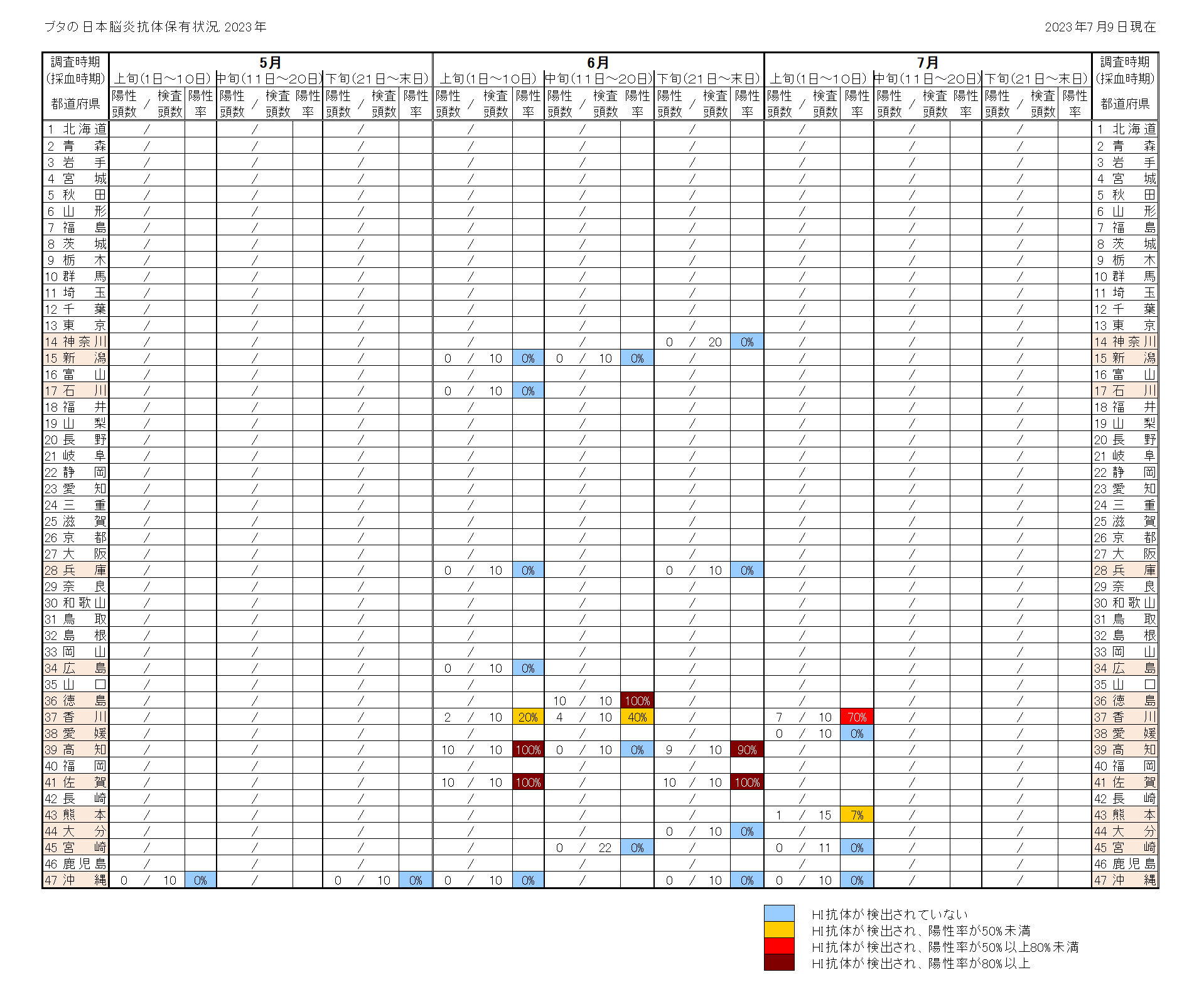 |
|
| 抗体保有状況 (地図情報) 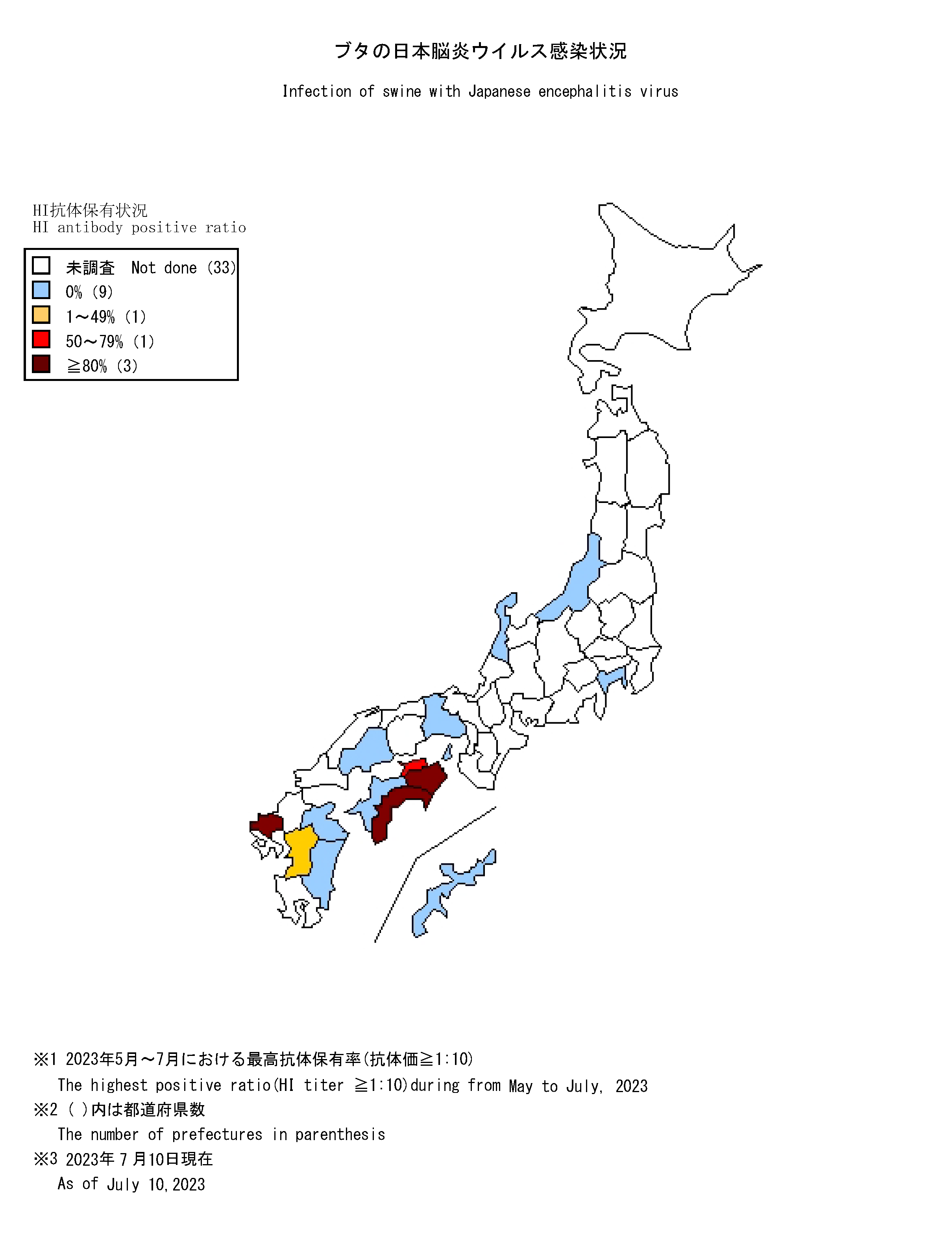 |
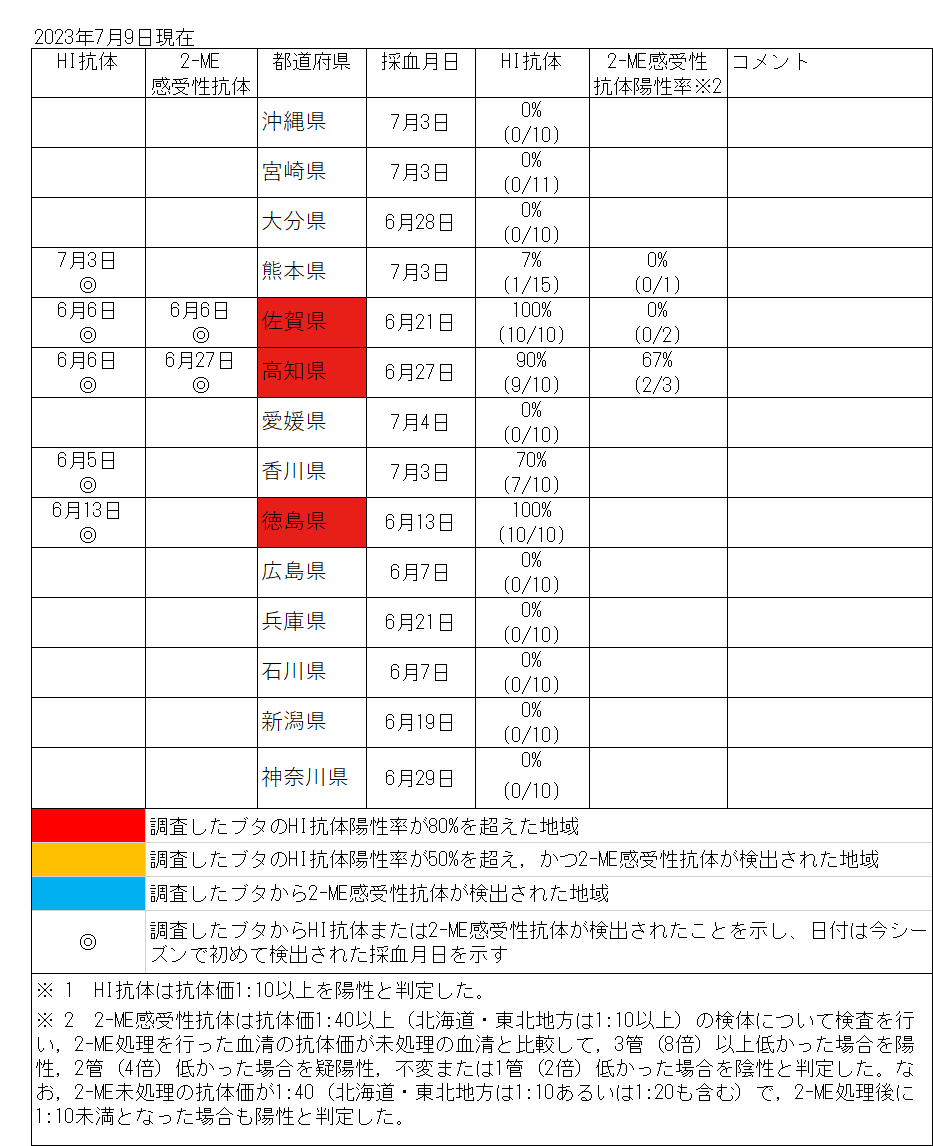 |
| 1. | 日本脳炎とは |
| 2. | 松永泰子,矢部貞雄,谷口清州,中山幹男,倉根一郎. 日本における近年の日本脳炎患者発生状況-厚生省伝染病流行予測調査および日本脳炎確認患者個人票(1982~1996)に基づく解析-. 感染症学雑誌. 1999. 73: 97-103. |
| 3. | Arai, S., Matsunaga, Y., Takasaki, T., Tanaka-Taya, K., Taniguchi, K., Okabe, N., Kurane, I., Vaccine Preventable Diseases Surveillance Program of Japan. Japanese encephalitis: surveillance and elimination effort in Japan from 1982 to 2004. Japanese Journal of Infectious Diseases. 2008. 61: 333-338. Pubmed |
| 4. | Konno, J., Endo, K., Agatsuma, H., Ishida, N., Cyclic outbreaks of Japanese encephalitis among pigs and humans. American Journal of epidemiology. 1966. 84: 292-300.Pubmed |
| 5. | 2015年夏に千葉県で発生した日本脳炎の乳児例. IASR Vol. 38 p.153-154: 2017年8月号. |
| 6. | 厚生労働省. 日本脳炎. (2023年7月10日アクセス) |
| 7. | 国立感染症研究所 予防接種スケジュール |
| 国立感染症研究所 感染症疫学センター/ウイルス第一部 | |