お知らせ
感染症情報
研究・検査・病原体管理
サーベイランス
刊行・マニュアル・基準
- 詳細
Development of an Efficient Entire-Capsid-Coding-Region Amplification Method for Direct Detection of Poliovirus from Stool Extracts.
Arita M, Kilpatrick DR, Nakamura T, Burns CC, Bukbuk D, Oderinde SB, Oberste MS, Kew OM, Pallansch MA, Shimizu H
Journal of Clinical Microbiology, 53: 73-78, 2015
ポリオ根絶計画が1988年に開始されて以来、ポリオ患者の確定診断のために、便抽出液から培養細胞を用いたポリオウイルス(PV)の分離・同定が行われている。しかし、判定に時間がかかるため、培養細胞を使わない検出法の開発が推奨されている。今回、50コピー以下のウイルスゲノムから、PVのカプシドタンパクコーディング領域全体(3.9 k nt)を増幅する新規法を開発した(ECRA法)。ECRA法と磁気ビーズPV濃縮法、リアルタイムPCRおよびVP1領域遺伝子解析を組み合わせることで、培養細胞を用いた場合と同程度の効率でPVを検出出来ることが示された。
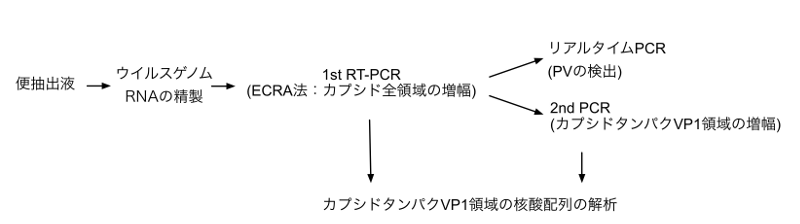
- 詳細
Phylogynamic Analysis Reveals CRF01_AE Dissemination between Japan and Nighboring Asian Countries and the Role of Intravenous Drug Use in Transmission.
Shiino, T., Hattori, J., Yokomaku, Y., Iwatani, Y., Sugiura, W. and Japanese Drug Resistance HIV-1 Surveillance Network.
PLoS One 9(7): e102633. doi:10.1371/journal.pone0102633
東南アジア諸国で流行しているHIV-1サブタイプの一つであるCRF01_AEは、我が国における疫学があまりわかっていない。我々は、日本薬剤耐性HIV-1サーベイランスネットワークに登録された3618名の患者のウイルス遺伝子配列を3種類の方法によって系統樹解析した。
続きを読む: 動的系統樹解析が明らかにしたHIV-1 CRF01_AEの我が国と隣接するアジア諸国との流行の関係と薬物利用者の役割
- 詳細
Phosphoregulation of the Ceramide Transport Protein CERT at Serine 315 in the Interaction with VAMP-associated Protein (VAP) for Inter-organelle Trafficking of Ceramide in Mammalian Cells.
Kumagai, K., Kawano-Kawada, M., and Hanada, K.
J Biol Chem 289, 10748-10760, 2014
セラミド輸送タンパク質CERTは、ヒトなどの細胞においてセラミドを小胞体膜からゴルジ体膜に輸送するタンパク質である。細胞内での通常の機能に加え、CERTはクラミジア感染時にハイジャックされ、寄生胞にセラミドを供給する装置として利用されることが報告されている。いずれのケースにおいても、CERTが小胞体膜のセラミドを運び出す際には、CERTのFFATモチーフと小胞体の膜貫通タンパク質であるVAPとの結合が重要な役割を果たす。
続きを読む: CERTのセリン315のリン酸化は、オルガネラ間のセラミド輸送に必要とされるCERT-VAP間の相互作用を調節する
- 詳細
Phosphatidylinositol-4 kinase III beta and oxysterol-binding protein accumulate unesterified cholesterol on poliovirus-induced membrane structure.
Arita M
Microbiology and Immunology, 58: 239-256, 2014
抗ポリオウイルス化合物を用いた解析から、ポリオウイルスの複製に必要な宿主細胞内経路としてホスファチジルイノシトール4-キナーゼ(PI4KB)/オキシステロール結合タンパク(OSBP)経路が同定されているが、PI4KB/OSBP経路がどのようにウイルスの複製を支えているかは謎であった。今回、この経路に関与するウイルスタンパク質を同定し、PI4KB/OSBP経路のウイルス複製における役割を解析した。その結果、ウイルスタンパク質2BC/3A/3ABがPI4KB活性を調整してホスファチジルイノシトール4-リン酸(PI4P)産生を促進し、産生されたPI4PにOSBPが結合しウイルス感染で誘導された膜上にコレステロールを蓄積することにより、ウイルス複製の場の形成を促進することが示唆された。
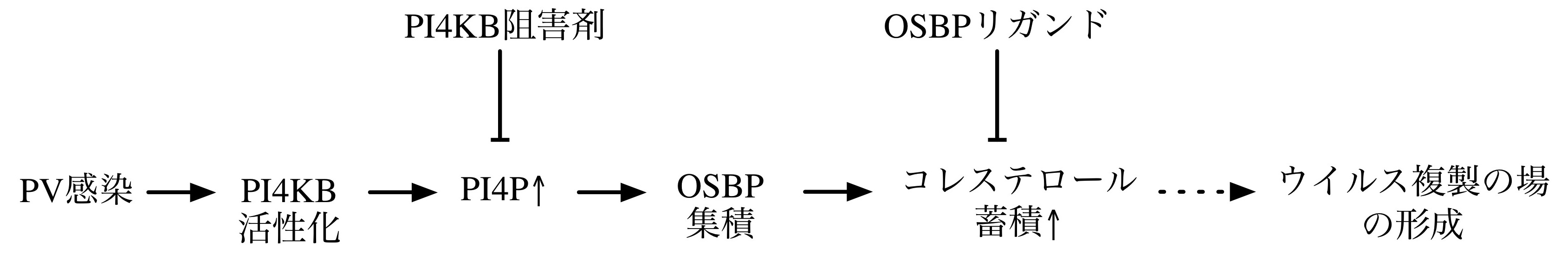
- 詳細
| ■ご覧いただく前に | |
| 各章毎にPDFファイルで収録しておりま す。 ご覧になるには、Adobe Reader6以上を推奨致します。 |
|
