お知らせ
感染症情報
研究・検査・病原体管理
サーベイランス
刊行・マニュアル・基準
- 詳細
![]() IL-33 is essential to prevent high fat diet-induced obesity in mice infected with an intestinal helminth.
IL-33 is essential to prevent high fat diet-induced obesity in mice infected with an intestinal helminth.
Seiji Obi*, Chikako Shimokawa*, Mizuki Katsuura, Alex Olia, Takashi Imai, Kazutomo Suzue, Hajime Hisaeda
*equally contributed
Parasite Immunology 2020, doi:10.1111/pim.12700
![]()
最近の研究で、二型自然リンパ球(ILC2)がマウスにおける肥満抑制に重要な働きをしていることが示された。ILC2は、特に寄生虫感染によって大量に誘導される細胞であるため、我々は寄生虫が感染することでも肥満を抑制することができるのではないかと考え、検討を行った。
- 詳細
![]() 国立感染症研究所ウイルス第三部で、新型コロナウイルスの分離に成功しました(図1)。使用した細胞はVeroE6/TMPRSS2細胞(TMPRSS2というプロテアーゼを発現している)です。臨床検体を接種後、細胞の形状変化を観察し、多核巨細胞の出現を捉えました。
国立感染症研究所ウイルス第三部で、新型コロナウイルスの分離に成功しました(図1)。使用した細胞はVeroE6/TMPRSS2細胞(TMPRSS2というプロテアーゼを発現している)です。臨床検体を接種後、細胞の形状変化を観察し、多核巨細胞の出現を捉えました。
細胞上清中のウイルスゲノムを抽出して、ほぼ全長のウイルスゲノムの配列を確定しました。これは、最初に発表されたウイルスの遺伝子配列と99.9%の相同性がありました。
分離したウイルスを用いて、ウイルス感染機構及び病原性の解析、ウイルス検査法・抗ウイルス薬・ワクチンなどの開発を進める予定です。また、新型コロナウイルス対策に役立てるため、ウイルスと細胞は国内外に広く配布する予定です。
以下の写真は、「感染症 画像・映像アーカイブ」の記事で一般に配布しております。
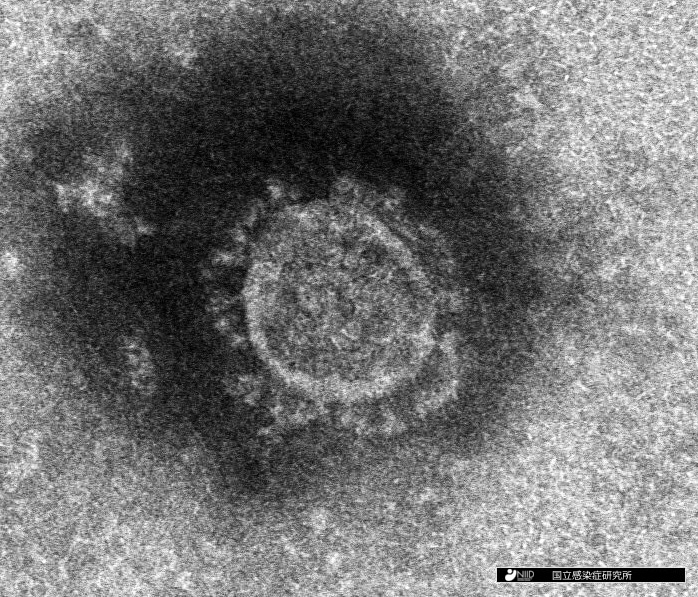
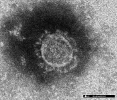
図1:当研究所で分離された新型コロナウイルスの電子顕微鏡写真像。粒状の粒子の上にコロナウイルス特有の冠状のスパイクタンパク質が観察できます。
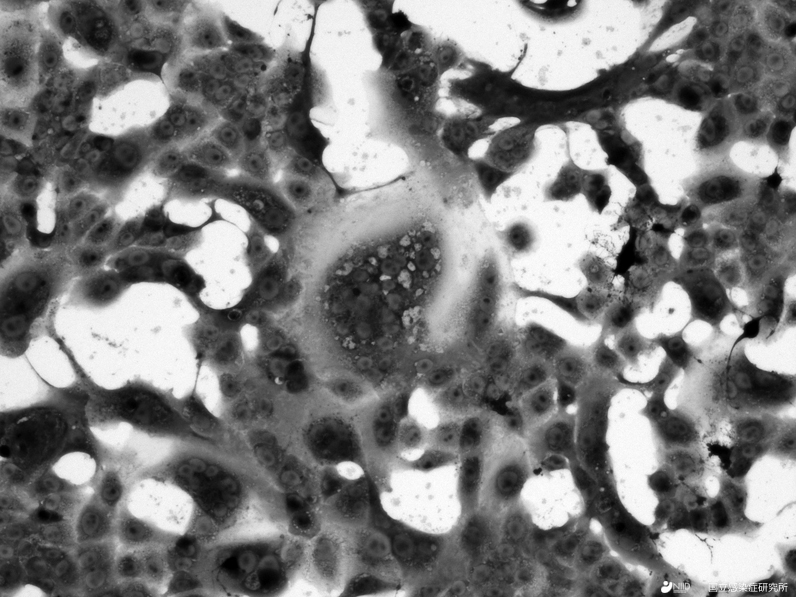
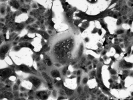
図2:VeroE6/TMPRSS2細胞に出現した新型コロナウイルスによる細胞変性像。画面の中央に多数の核の集積像(多核巨細胞像)が確認できます。
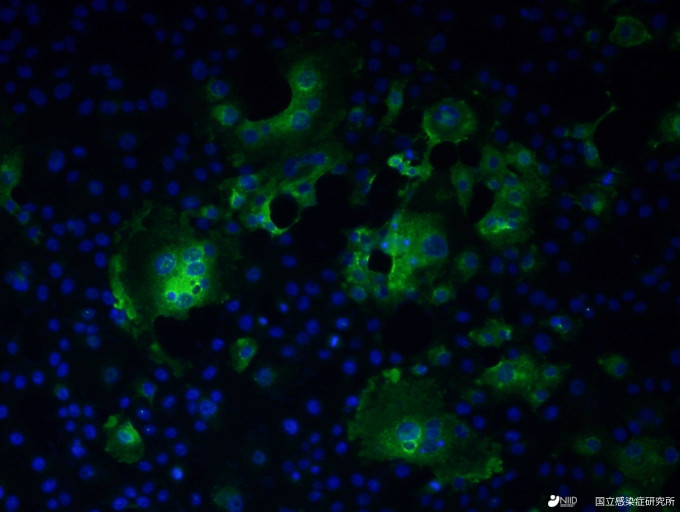
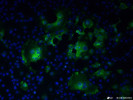
図3:2019-nCoVに感染した細胞の蛍光抗体染色像
- 詳細
国立感染症研究所ウイルス第三部で、新型コロナウイルスの分離に成功しました。使用した細胞はVeroE6/TMPRSS2細胞(TMPRSS2というプロテアーゼを発現している)です。臨床検体を接種後、細胞の形状変化を観察し、多核巨細胞の出現を捉えました。
細胞上清中のウイルスゲノムを抽出して、ほぼ全長のウイルスゲノムの配列を確定しました。これは、最初に発表されたウイルスの遺伝子配列と99.9%の相同性がありました。
分離したウイルスを用いて、ウイルス感染機構及び病原性の解析、ウイルス検査法・抗ウイルス薬・ワクチンなどの開発を進める予定です。また、新型コロナウイルス対策に役立てるため、ウイルスと細胞は国内外に広く配布する予定です。
※下のサムネイル画像をクリックすると、大きな画像を取得することができます。
- 詳細
Streptococcus pneumoniae triggers hierarchical autophagy through reprogramming of LAPosome-like vesicles via NDP52-delocalization.
Michinaga Ogawa, Naoki Takada, Sayaka Shizukuishi, Mikado Tomokiyo, Bin Chang, Mitsutaka Yoshida, Soichiro Kakuta, Isei Tanida, Akihide Ryo, Jun-Lin Guan, Haruko Takeyama, Makoto Ohnishi
Commun Biol 3, 25 (2020) doi:10.1038/s42003-020-0753-3
肺炎の主要な原因菌である肺炎球菌は、時に重篤な侵襲性肺炎球菌感染症(IPD)を引き起こす。IPDを起こすためには肺炎球菌が細胞の中を通り抜ける必要があるが、今までに我々は、細胞に侵入した肺炎球菌はゼノファジー(殺菌的オートファジー)により殺菌されることを報告している。今回、我々は肺炎球菌がオートファジーで殺菌されるプロセスに着目した。
- 詳細
Severe fever with thrombocytopenia syndrome virus targets B cells in lethal human infections.
Tadaki Suzuki, Yuko Sato, Kaori Sano, Takeshi Arashiro, Harutaka Katano, Noriko Nakajima, Masayuki Shimojima, Michiyo Kataoka, Kenta Takahashi, Yuji Wada, Shigeru Morikawa, Shuetsu Fukushi, Tomoki Yoshikawa, Masayuki Saijo, and Hideki Hasegawa
J Clin Invest. 2020 Jan 6. pii: 129171.
![]()
重症熱性血小板減少症候群(Severe fever with thrombocytopenia syndrome; SFTS)は、SFTSウイルス(SFTSV)によるマダニ媒介性のウイルス性出血熱である。本研究では、SFTSで死亡した患者体内でのSFTSV感染細胞はマクロファージと「抗体産生細胞である形質芽球に分化しつつあるB細胞」であることを明らかにした。さらに、本研究ではヒト形質芽球と似た特徴を持つ培養細胞株のPBL-1細胞を用いて、SFTS患者の体内で起こるウイルス感染を試験管内で再現が可能なSFTSV感染の実験系の開発にも成功した。
- 詳細
![]() Immune-Focusing Properties of Virus-like Particles Improve Protective IgA Responses.
Immune-Focusing Properties of Virus-like Particles Improve Protective IgA Responses.
Onodera T, Hashi K, Shukla R, Miki M, Takai-Todaka R, Fujimoto A, Kuraoka M, Miyoshi T, Kobayashi K, Hasegawa H, Ato M, Kelsoe G, Katayama K, and Takahashi Y.
J Immunol. 2019 Dec 15;203(12):3282-3292. doi: 10.4049/jimmunol.1900481.
ノロウイルス感染症に対するワクチンとして、ノロウイルス様粒子(VLP)ワクチンの臨床開発が進められているが、その有効性評価を可能とする免疫サロゲートは特定されていない。本研究では、ノロウイルスVLPワクチンが惹起するヒト防御液性免疫を様々な免疫学的手法を駆使して解析した。